肿瘤细胞中ecDNA新机制在斯坦福大学致癌基因研究应用-1
文章导读
eccDNA是染色体外的一种特殊的环状DNA,从它的出现至今已长达数年,但在起初的很长一段时间里并未得到人们的重视。随着高通量技术的发展,eccDNA(extrachromosomal
circular
DNAs,eccDNAs)作为染色体外的环状DNA的研究也进一步深入。在国际学术期刊《Nature》和《Cell》上相继发表的关于eccDNA在肿瘤的发生和发展中具有重要功能的报道使eccDNA成为了基因组学研究中的一个爆点。这两篇文章中认为eccDNA能够促进肿瘤细胞中原癌基因的表达,这一重要发现使eccDNA成为科研界关注的热点话题。
然而关于eccDNA在肿瘤细胞内的空间位置及作用机理仍未可知。近期,美国斯坦福大学研究团队在bioRxiv
预先发表了一篇题目为“EcDNA hubs drive cooperative intermolecular oncogene
expression”的文章,对癌症细胞中ecDNA
hubs(ecDNA聚集成簇)在致癌基因的表达中发挥重要的作用提出了一个新的分子机制,这为解析ecDNA在癌症细胞中的作用提出一个新方向,也为癌症治疗提供了新的理论基础。

发表平台: bioRxiv
发表日期: 2020.11.20
实验方法: WGS, RNA-seq, ChIP(以上服务云序均可提供)
文章链接:EcDNA hubs drive cooperative intermolecular oncogene expression
研究内容
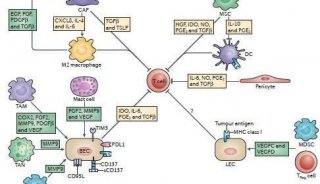
此前研究发现ecDNA是大小约100kb-几Mb的双链环状DNA。由于其自身没有着丝粒,因此在细胞分裂中可随机分配到子细胞,这一特性使ecDNA在肿瘤耐药性方面发挥作用。而且,ecDNA也可以重新整合到染色体上或者形成重复序列(HSRs)。此外,ecDNA相比于染色体DNA有更加松散的结构,更适于其携带的致癌基因的转录和表达。ecDNA存在于正常染色体之外,其在细胞核中的空间组织目前还不清楚。但值得注意的是,ecDNA在某些生物学过程之后会发生聚集。本文中作者展示了由10-100个ecDNA聚集组成的ecDNA簇,它们聚集在间期细胞核内,驱动分子间增强子的重排从而驱动致癌基因表达。本研究中,通过检测在MYC-PVT1融合基因的ecDNA空间、表观和转录水平的动态变化,发现ecDNA hubs作为一个组合的增强子集合体,对致癌基因的转录发挥调控。
研究结果
(1)ecDNA hubs是癌基因转录的主要位点
为了了解ecDNA在转录过程中的空间背景,作者使用DNA荧光原位杂交技术(FISH)分别在前列腺癌(PC3)、结直肠癌(COLO320-DM)、胶质母细胞瘤(HK359)以及胃癌(SNU16)中可视化了ecDNA在间期期间在细胞核中的定位,发现这些ecDNA是几十到几百个聚集在间期细胞的细胞核的特定区域,这表明ecDNA
相互之间具有很强的聚集性,称之为ecDNA hubs。为了评估ecDNA
hubs的转录活性,作者结合了DNA和新生RNA利用FISH检测了在PC3和COLO320-DM细胞系中MYC等位基因的转录活性,发现ecDNA
hubs上致癌基因的转录的概率明显高于染色体位点,且发现MYC转录概率与ecDNA聚类之间有显著的相关性。因此,当更多的ecDNA在同一细胞聚集时,ecDNA
hubs更有可能转录癌基因。

(2)单细胞水平识别与强效癌基因表达相关的ecDNA增强子
为了了解ecDNA上致癌基因表达的调控,作者在单细胞水平上鉴定了与癌基因高表达相关的ecDNA上的调控元件并检测了癌细胞的异质性,以及ecDNA与癌基因转录的关系。作者采用单细胞组学的方法,使用ATAC-
seq和RNA-seq共检测到结直肠癌细胞系col320
-DM和COLO320-HSR中72049个细胞获得的转录组和染色质开放性图谱。进一步整合了每个细胞的转录组和染色质开放性图谱,发现MYC的开放性随RNA表达而增加。MYC在COLO320-DM中的表达与开放性相比于COLO320-HSR是高度异质的。这些结果表明,调控元件可以影响ecDNA在癌基因表达中的细胞间差异。为了鉴定细胞中表达高水平MYC的ecDNA上的活性调控元件,ATAC-seq比较表明,高MYC表达的COLO320-DM细胞既包含更高的ecDNA拷贝数,也包含更多的调控元件,在ecDNA上的差异峰分析鉴定出47个与MYC高表达密切相关的调控元件,而在染色体HSRs上鉴定出5个调控元件,这些结果表明,MYC
转录的增加与ecDNA中许多调节元件有关。总之,这些结果表明,细胞间增强子的差异可能是ecDNA 癌基因表达异质性的关键。

(3)增强子和启动子之间的分子间互作促进ecDNA 的异质化和致癌基因的表达
由于发现(i)细胞核内的ecDNA hubs与活跃的癌基因表达相关,(ii)
ecDNA的癌基因表达与差异调节元件相关,作者下一步研究这些差异元件是否参与不同的ecDNA分子之间的增强子-启动子相互作用。作者整合了WGS、单分子DNA测序和3D
增强子连接体图谱,分析ecDNA
hubs对致癌基因表达的调控。先根据之前的WGS的数据,检测COLO320-DM细胞中ecDNA在MYC位点有重排,确定了PVT1能和MYC的外显子2和3发生融合,并采用nanopore三代单分子测序的方法进行了验证,结果显示ecDNA分子在COLO320-DM中存在高度的异质性。随后采用HiChIP检测了COLO320-DM和COLO320-HSR中H3K27ac与激活型增强子和ecDNA的作用,发现在ecDNA的拷贝数高的COLO320-DM中H3K27ac与激活型增强子结合越紧密。此外,通过ATAC-seq鉴定了大量的激活型增强子,结果发现其与MYC基因有相互作用。综上结果,作者认为增强子和启动子之间的互作促进ecDNA的异质化和致癌基因的表达。

(4)BRD4连接ecDNA hubs并驱动癌基因转录
广泛的远距离接触和H3K27ac相关的DNA接触提高了BET蛋白可能参与ecDNA
hubs转录的可能性。BET是染色质阅读蛋白,为了检测BET蛋白在ecDNA促进转录作用,检测在两种细胞中MYC位点BRD4的定位情况。根据H2K27ac,BRD4的ChIP-seq结果和ATAC-seq数据,表明H3K27ac
存在的激活的ecDNA增强子,与BRD4同时存在,BRD4连接ecDNA hubs,促进致癌基因的转录。为了评估BET抑制剂JQ1在ecDNA
hubs的功能中作用,作者进行了JQ1处理,发现加入JQ1后ecDNA出现分散,且具有细胞特异性。而加入RNA
PolII抑制剂,降低MYC的转录但不影响ecDNA hubs的聚集。通过新生RNA和DNA
FISH和BRD4的ChIP-seq结果表明ecDNA hubs的形成依赖于BET蛋白,而ecDNA
hubs的破坏会引起MYC致癌基因转录的抑制和ecDNA癌细胞的死亡。除了BET的抑制剂会抑制ecDNA的转录,作者还发现CRISPR的干扰剂,也可以抑制PVT1的启动子,降低PVT1-MYC的转录从而降低总的MYC的RNA水平。这一结果显示ecDNA可能是调控致癌基因表达的一个更有效的思路。