显微成像技术在干细胞研究中的应用
干细胞涉及到个体发育、器官移植、延缓衰老、癌症治疗等方方面面。单个的干细胞是如何分裂、分化成新的细胞、组织或器官呢?在成体中,干细胞又是如何完成细胞修复更新的使命呢?在下面的文章中,我们将介绍如何借助共聚焦、双光子等显微成像分析技术一一解决在干细胞研究中的这些问题。
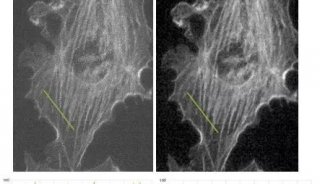
激光共聚焦扫描显微镜可以精确可控的进行的光学切片,清晰呈现细胞每一层的亚结构信息,这对研究研究蛋白定位、细胞器分化等非常重要。如需研究氯胺酮(Ketamine)对iPSC诱导的神经元线粒体形态的影响,即可采用共聚焦呈现清晰图像。

图1 氯胺酮(Ketamine)对iPSC诱导的神经元线粒体形态的影响。
(Ketamine Causes Mitochondrial Dysfunction in Human Induced Pluripotent Stem Cell-Derived NeuronsHiroyuki Ito, Tokujiro Uchida, Koshi Makita. PLoS One. 2015; 10(5): 2015 May 28. doi: 10.1371/journal.pone.0128445)
这种药物刺激实验,往往需要在活细胞中加入药物并实时跟踪。那么如何保持细胞的活性呢?很简单,只需要将细胞培养环境重现在显微镜上即可,可称之为Live on the Stage。目前徕卡LAS X软件系统提供从采集拍摄到分析一站式服务,而且还可以是在线控制细胞生长的温度、湿度、CO2等各种环境条件。下图是常见的大箱式培养装置及小型细胞培养箱:

图 2 显微镜上常用的培养装置。(左图:大箱式培养装置,整个显微镜环境更稳定;右图:小型培养装置,便于操作)
有些细胞形态甚至命运的变化需要很长时间才能体现出来,那么长时间培养拍摄过程中焦面的稳定尤为重要。德国品质保证了徕卡显微镜本身超强的稳定性,同时徕卡还提供AFC(Adaptive Focus Control,自动焦面控制系统)实时追踪稳定细胞培养皿底与物镜之间的物镜距离,硬件上保证焦面的稳定;但是由于细胞生长自身引起的焦面变化怎么办呢?徕卡软件Best Focus,提供五种算法,无论明场还是荧光成像,均可实时最终目标细胞。有了这些硬件、软件焦面稳定保障,再也不用担心细胞不见了。
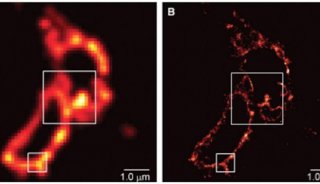
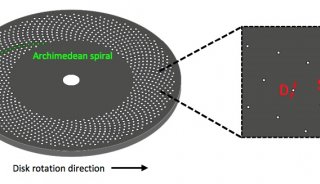
干细胞研究中常常设计多个基因或多种刺激条件,很显然每次只对一个样品成像不仅效率低下而且实验重复性差。此时即可采用徕卡的多点扫描成像(Mark and Find,适用于每个点成像要求一致,样品点不是很多)或高内涵成像(HCS,适用于多点、多孔板、负责实验)。如下图所示,HCS不仅可以对多孔板的多个孔自动成像,还可以对不同孔采用不同的成像条件,满足各种复杂实验需求。

图3 HCS高内涵成像。
干细胞成像研究后期均要进入体内研究,目前已有多重方法追踪单个干细胞的最终分化命运,如常见的R26R-Confetti 转基因策略。这种方法涉及到CFP、GFP、YFP及RFP四种荧光蛋白的表达, 而这四种荧光蛋白的激发光谱和发射光谱(图5,左图)非常接近,特别是GFP和YFP,非常容易串色,对共聚焦显微镜提出了苛刻的要求。徕卡采用ZL的棱镜分光,狭缝检测系统,可自由调节检测器对荧光信号的接收范围,最大效率收集荧光信号,避免串色;同时,在分光镜上突破传统的二向色镜,不在受限于滤镜镀膜限制,采用完全自由的AOBS系统(图5, 右图),配合光谱式检测器,完全实现自由检测,最大程度上避免荧光串色,直接得出实验结果,而无需再采用软件串色分离等后期图像处理。


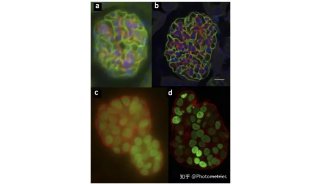
图4 R26R-Confetti 转基因原理及应用。
上图:R26R-Confetti 转基因原理:编码四种荧光蛋白的Brainbow2.1被插入到的Rosa26位点处,Cre激活后,neomycin被剪切掉,四种荧光蛋白随机表达在不同的细胞中且在细胞中的定位有所不同,GFP核定位,CFP特异性表达在细胞膜,另外两种则是胞质定位。
下图:多种组织中利用R26R-Confetti追踪干细胞命运。标尺: 50 um; Pancreas/Kidney/Liver中标尺为100 um。
(Cell. 2010 Oct 1;143(1):134-44. doi: 10.1016/j.cell.2010.09.016.
Intestinal crypt homeostasis results from neutral competition between symmetrically dividing Lgr5 stem cells. Snippert HJ1, van der Flier LG, Sato T, van Es JH, van den Born M, Kroon-Veenboer C, Barker N, Klein AM, van Rheenen J, Simons BD, Clevers H.)

图5 CFP、GFP、YFP及RFP四种荧光蛋白的激发和发射光谱及AOBS系统。
干细胞生长的微环境对于干细胞的功能、命运至关重要,无论是体外模拟干细胞生长的3D环境还是直接观察体内的干细胞,在成像时均需要较高的穿透深度和灵敏度,此时多光子显微镜因为具有更高的穿透性、更低的光毒性,比常规共聚焦显微镜有更大的优势。结合高精度载物台及软件记忆功能,可实现在体(In vivo)干细胞分裂、分化的长时间跟踪。如在跟踪小肠隐窝单细胞命运的实验中,不能把实验小鼠放在显微镜载物台上连续培养拍摄跟踪,那么如何跟踪单个细胞的命运?如何能在下一个实验时间点准确的找到原来的拍摄位置呢?其实可以借助显微镜上配的高精度电动载物台及软件的记忆功能,以小鼠的血管等有显著结构的部位作为参考点,顺利在每次拍照中找到原来的拍摄视野(图 6)。这样不仅可以利用双光子显微镜重现整个隐窝中干细胞的三维立体分布
还可以将多天长时间拍摄的图片连接起来还原单个干细胞的命运。

图6 追踪还原体内成像的拍摄视野。a)成像视野的相对坐标可以被软件记录并存储调用;b)小鼠的血管结构可以用做参考点;c) 成像视野被找到并拍摄,标尺20 um。
(Nature. 2014 Mar 20;507(7492):362-5. doi: 10.1038/nature12972. Epub 2014 Feb 16.)
显微成像技术使得干细胞的分化、发育等过程变得实时可见。本文中囿于篇幅限制没有提及的超高分辨率显微成像技术更能在纳米水平清晰揭示干细胞中亚结构的变化,相信能为干细胞研究提供另一把利器。