合成生物|人造细胞的里程碑
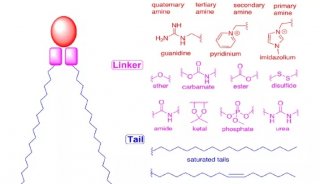
每只细胞都需要一个外壳,不仅如此,细胞内部被脂质分隔成不同独立空间。为了创造适合“人造活细胞”生存的必需环境,合成生物学家希望开发具化学和物理稳定性的细胞外壳。
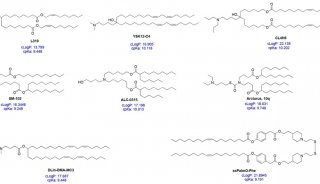
德国马普学会(Max Planck Society)和University of Heidelberg, University of Jena,University of Magdeburg,University of Bordeaux等机构的研究人员采用新技术生产了一系列不同类型的脂肪酸,它们能组装成极像天然细胞膜的微粒,接下来科学家们又向微囊泡中填充天然蛋白质,并将这些蛋白质整合到脂质层内。
建立脂质微粒是创建天然细胞模型系统的必经步骤。天然细胞膜的结构看起来简单,实际上它们的特性却很难人工重现。过去构建的人造细胞“外壳”仅是些不稳定的无孔脂肪分子,以至于不能加载许多细胞进程分子。
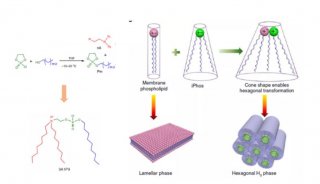
在这篇《Nature Materials》(doi:10.1038/nmat5005)文中,Max Planck的科学家和同事们使用名为“两亲性聚合物(amphiphilic polymers)”的长链有机分子形成液滴,液滴外层由全氟聚醚(perfluorinated polyether)构成,内层由附着金纳米颗粒的水溶性聚乙二醇(polyethylene glycol)构成。内外层表面活性剂组分差异使液滴得以漂浮在含油介质中,同时还能保持内部的水溶性。
通过微注射系统,研究人员向聚合液滴中注入微小的脂质囊泡。加入镁离子,可以让液滴中的小囊泡们打开再合并形成一个独立的单分子层膜内结构。
“这些脂质囊泡的机械和化学性都很稳定,如此,我们就能将天然细胞蛋白嵌入其中,”Joachim Spatz说。使用专门开发的picoinjection注射系统,研究人员能精确地控制注入的蛋白质数量。“这种技术每秒能精准嵌合1000个细胞蛋白(如肌动蛋白和微管蛋白或跨膜整合蛋白)进入微囊泡,如此快的处理速度足够用于生物或医学研究分析,”Spatz解释道。
之后,科学家们去掉了脂质微粒的表面活性剂,将这些脂质囊泡转移到水溶液中,使这些小囊泡适用于天然细胞相互作用。
这项研究不仅是代表着人工合成细胞的一大进步,实际上它也提供了一个可用于宿主细胞和病毒相互作用信号分子研究的简单模型系统。
-
焦点事件

-
焦点事件

-
项目成果
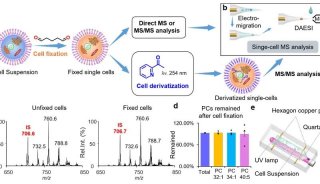
-
科技前沿
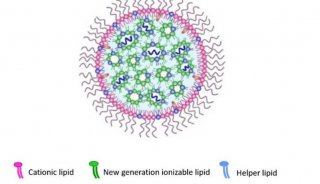
-
企业风采

-
焦点事件
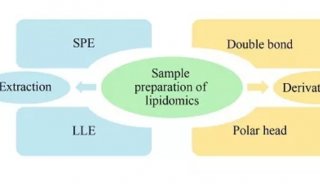
-
焦点事件