EBioMedicine:游走在癌症“杀手”之中的“内吞机制”变化—定量蛋白质组学技术

点击上方“蓝色字体”关注我们
鹿明
生物
蛋白、代谢组学服务专家
关注我们收获更多
关注


前言
2019年8月,被评为世界领先地位的塞尔大学的生化系的课题组在EBioMedicine杂志(IF=6.68)发表题为“Quantitative proteomics reveals reduction of endocytic machinery components in gliomas”的研究论文,该研究采用定量蛋白质组学分析技术和生物信息学分析法对人脑胶质瘤组织切片研究,发现多种途径被上调和下调与内吞载体的起始、形成和切断有关的多种机械成分大量减少有关,对临床开发与应用提供了重要的依据。

标题:定量蛋白质组学揭示神经胶质瘤中内吞机制成分的减少
研究对象:人活检胶质瘤组织切片样本
期刊:EBioMedicine
影响因子:6.68
发表时间:2019年8月
运用生物技术:定量蛋白质组学

研究背景
神经胶质瘤是中枢神经系统中最常见,最具侵袭性的恶性肿瘤。数十年的分子遗传学分析表明,神经胶质瘤积累的遗传改变导致生长因子受体酪氨酸激酶(RTK)和下游信号通路的介质活性增强。其中EGFR、PDGFR、PI3KA和BRAF的功能增强,PTEN和NF1的功能丧失,导致增殖反应加剧。尽管遗传学改变目前已得到充分确立,但关于不同等级和亚类的神经胶质瘤的蛋白质组学变化的信息却很少。为了确定新的靶标和调节机制,本研究采用定量蛋白质组技术分析了从各种神经胶质瘤等级和遗传亚型患者中获取的神经胶质瘤活检样品。

实验方法

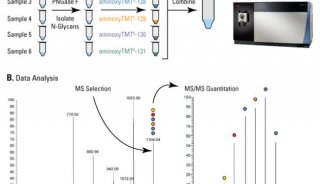
图1 | 胶质瘤和对照活检的蛋白质组学研究流程
1. 活检样本收集
从接受手术切除神经胶质瘤的患者中收集样品。为了使胶质瘤样本与对照组织相匹配,从接受癫痫手术的患者身上采集了活检组织。切除后立即将组织速冻并保存在液氮中直至使用。
2. 蛋白质和多肽的制备,质谱和生物信息学分析
质谱仪:Orbitrap Lumos Tribrid(Thermo Scientific);
搜库软件:Proteome Discoverer 2.2(Thermo Scientific),检索引擎:Mascot和Sequest HT search engines;
3. 原代细胞培养及细胞表面生物素测定
原代细胞来源:神经胶质瘤活检(BTB152和BTB251)获得的原代细胞;
4. 凝胶电泳和免疫印迹分析
5. 组织切片

实验结果
1.脑胶质瘤的定量蛋白质组学
作者共鉴定出12687个蛋白,其中4029个蛋白质上调,1722个蛋白质下调。挑选2倍倍数变化的差异表达蛋白做功能分析。从下调蛋白质的生物学分类中,研究集中在非常紧密的语义簇VI上,该簇被注释为“clathrin-结合簇”(图2c)。
对于该簇中存在的蛋白质,计算了单个胶质瘤活检组织和对照组之间的Log2
转化率。结果显示,在细胞膜上,参与CCV和CIE载体产生的各个阶段的内吞机制成分显著减少,包括引发剂、主要和替代结构性涂层成分、涂层相关激酶、膜曲率传感器和弯曲器,以及与运输载体的断裂和脱膜有关的因素(图 2d)。
具有明确表型的CCV生产中的关键参与者是AP-2,clathrin和dynamin。除了dynamin 2(与dynamin1和3相比,在脑组织中仅少量表达),所有这些成分均显示出蛋白量至少减少了2倍。在分析中,受影响最严重的蛋白是EndoA1-3(图2d)。EndoA1-3是经典CME机制的一部分,目前研究表明其也参与了CIE途径,特别是FEME途径。由于动态蛋白水平降低(CME和多条CIE途径依赖于此),胶质瘤可能在细胞内吞过程中受到损害。
虽然绝大多数的内吞机制蛋白剧烈减少,但一些替代的适应体,包括Dab2和stonin 1、2,以及内吞先驱FCHo2被显著地上调(图2d)。Dab2、stonins的上调可能提供了一种AP-2独立的解救机制,以分别补偿LDLR或突触小泡成分的摄取不足。相反,FCHo1、2显示相反的调节(图2d),可能指示不同的功能。

图2 | 定量蛋白质组学分析显示内吞机制成分的强烈减少
(a)从单个脑胶质瘤活检中鉴定出的蛋白质数量;
(b)上调(红色)、下调(蓝色)的蛋白质数量统计;
(c)胶质瘤中上调(左)或下调(右)的REVIGO蛋白聚类;
(d)通过绘制胶质瘤组织切片中单个内吞成分与对照组相比的log2比值,对上调(红色)和下调(蓝色)的内吞机制成分进行蛋白质组学定量。
2.脑胶质瘤的免疫印迹分析
为了验证蛋白质组学数据,通过免疫印迹分析了内吞作用不同阶段的一些代表性成分(图3a)。AP-2复合物的两个亚单位,这是CME发生和发展的核心成分。主要的脑特异性α-适应素(αA)免疫印迹产生的信号与蛋白质组数据相似,在BTB152、213和219中的表达特别低(图3a)。β-亚单位的减少也可以观察到。参与TGN向内皮细胞内转运的AP-1复合物的β1,由于现有的抗体对AP-2的β2不是特异性的,因此其明显较低。AP180在大多数活检中也明显缺失。与蛋白质组数据一致,免疫印迹进一步证明了clathrin重链(CHC17)的大幅减少。

图3a | 免疫印迹分析
(a) 免疫印迹分析选定的内吞机制成分;
CME和大多数CIE新生载流子的分裂是由动力学驱动的。用抗dynamin 1/2的抗体检测胶质瘤匀显示出剧烈下调(图3a)。EndoA1也参与了不依赖clathrin蛋白的FEME途径,在所有分析的活检组织中都被严重消耗掉(图3a)。在内质蛋白中,EndoA1是最丰富的,因此可能是大脑中最相关的内质蛋白。以前的研究主要依赖于EndoA2,这是由于使用了非神经元HeLa和BSC1细胞。值得注意的是,EndoA1的下调与许多癌症相关,如乳腺癌、喉癌、肺癌、垂体腺瘤和尿路上皮癌。总之,免疫印迹分析及定量蛋白质组学有力地证实了我们的发现,并提示胶质瘤细胞内吞存在严重缺陷。
3. 协同的内吞机制下调改变受体分布
蛋白质组学结果显示,在脑胶质瘤中,CME和FEME通路中的大多数机制成分都受到显著的下调。已知这些途径的下调阻碍了受体的有效内化,从而使其稳态分布向细胞表面转移。为了在实验上验证这一点,研究比较了两种原代细胞培养物中转铁蛋白受体(TfR)和表皮生长因子受体(EGFR)的细胞表面部分,这两种原代细胞培养物来源于一种相对温和的活检(BTB251)和另一种来源于大量减少内吞机制成分的活检(BTB152)。
免疫印迹证实,与BTB251相比,BTB152中的AP-2、CHC17、EndoA1和dynamin明显减少,两个原代细胞系保留了各自活检的表型(图3b)。当两种细胞系结合相同量的Tf生物素时,BTB152显示总TfR减少约30%,从而使表面转铁蛋白受体部分增加 43 ± 6%。考虑到BTB251已经显示出AP-2和CHC17的部分缺失,这一结果与之前的报告一致,即 AP-2、clathrin、dynamin被抑制或耗竭时,细胞表面的受体大约增加60-120%。

图3b | BTB251和BTB152的原代细胞之间TfR的稳态分布
改变了来自BTB251和BTB152的原代细胞之间TfR的稳态分布,内吞机制分别轻度和剧烈减少。相对于BTB251(四个独立实验的平均值和标准差),BTB152细胞表面TfR的累积量以百分比表示。BTB衍生的原代细胞也显示了内吞机制成分(Dyn 1/2,AP-2α,CHC17,EndoA1)的减少。
以类似的方式,EGFR的质膜数量也用细胞表面生物素化法测定。用链霉亲和素珠沉淀生物素标记的EGFR受体,然后用抗EGFR受体抗体进行检测,进行免疫印迹分析。虽然两种细胞系的EGFR总量不可区分,但BTB152来源的原代细胞在质膜处的EGFR稳态水平(8 ± 3%)略高于BTB251细胞,表明受体向细胞表面转移。
4.内吞缺陷是各种神经胶质瘤亚型的共同特征
为了检验内吞机制的下调是否仅限于目前分析的8例胶质瘤活检,是否在不同的胶质瘤亚类中也有发现?作者额外取样了38例活检,分别属于间充质胶质瘤、经典胶质瘤、星形细胞瘤和少突胶质瘤。用抗dynamin、AP-2、CHC17和EndoA1的抗体探测这些活检的免疫印迹表明,这些蛋白质在几乎任何情况下都有不同程度的减少(图3d)。

图3d | 内吞机制成分在不同的胶质瘤亚型中下调
主要的内吞机制成分(Dyn1/2,AP-2α,CHC17,EndoA1)在不同的胶质瘤亚型中下调
内吞性机械成分的消耗最强是在经典GB中发现的,其中所有成分都被消耗至非致瘤性白质所致对照的10%或更少。间充质胶质瘤、间变性星形细胞瘤和少突胶质瘤均表现为减少,但其类型更不均匀,一致性较差。不考虑任何遗传背景,所有胶质瘤亚类都有一个共同点,即与非肿瘤组织相比,它们通常显示磷酸化Akt473水平升高。虽然神经胶质瘤亚类的内吞机制成分被大量耗尽,但对照组的白质标本始终表现出恒定的表达水平。

实验结论
在本研究中,通过定量蛋白质组学分析了不同级别的胶质瘤活检,发现多种内吞机制成分协同减少。通过进一步扩展对其他亚类的分析,发现脑胶质瘤的一个共同特征是细胞内吞的下调。而与细胞内吞有关的个别蛋白质的异常表达与人类癌症有关。
研究认为减少内吞机制成分是通过RTKs促进肿瘤发生的策略之一。除了揭示内吞成分的下调,本研究还提供了大量在胶质瘤中定量调节的蛋白质。在胶质瘤研究的背景下,这个数据存储库以及涵盖其他亚型的数据队列对于发现和开发新的治疗策略,以及对于理解其他癌症和一般的致癌具有作用。
小鹿推荐
本文运用定量蛋白质组学技术探索了人神经胶质瘤的蛋白质组变化,首先对人脑胶质瘤组织切片进行了定量蛋白质组学研究,其次做了原代细胞培养和免疫印迹分析,作者发现了与胶质瘤级别和亚类无关,参与CME和FEME载体形成的多种内吞机制成分都显著减少。基于此提出,受损的内吞作用通过增加生长因子感受和延长细胞表面RTK信号为胶质瘤肿瘤进展提供了选择性优势。
这篇文章通过定量蛋白质组学揭示了人脑胶质瘤细胞内吞机制在不同程度上的关闭,同时提供了胶质瘤中可定量调节的蛋白质,可用于临床上的开发利用,十分值得借鉴。
文献参考
【1】Dominik P. Buser ,Quantitative proteomics reveals reduction of endocytic machinery components in gliomas .EBioMedicine. 46(2019) 32–41
猜你还想看
END

我知道你在看哟


点“阅读原文”了解更多