Cell |【单细胞多组学】揭示肥胖竟会抑制肿瘤免疫?

肥胖,是当今世界的一种流行病,也是多种癌症的主要风险因素。多年来,科研人员已经鉴定出一些与肥胖相关的,可以导致肿瘤发生的因子,但是尚未报道肥胖引起的系统代谢变化如何影响局部肿瘤微环境 (TME) 中的免疫细胞。
哈佛医学院研究团队通过构建肥胖小鼠模型,并利用单细胞转录组测序、蛋白质组、代谢组等技术揭示了在高脂肪饮食条件下,肿瘤细胞可以重塑肿瘤微环境中的系统代谢途径,间接的影响免疫细胞的肿瘤浸润以及抗肿瘤免疫,相关研究结果发表在《Cell》上。

Obesity Shapes Metabolism in the Tumor Microenvironment to Suppress Anti-Tumor Immunity
肥胖重塑肿瘤微环境中的代谢途径进而抑制抗肿瘤免疫
技术路线

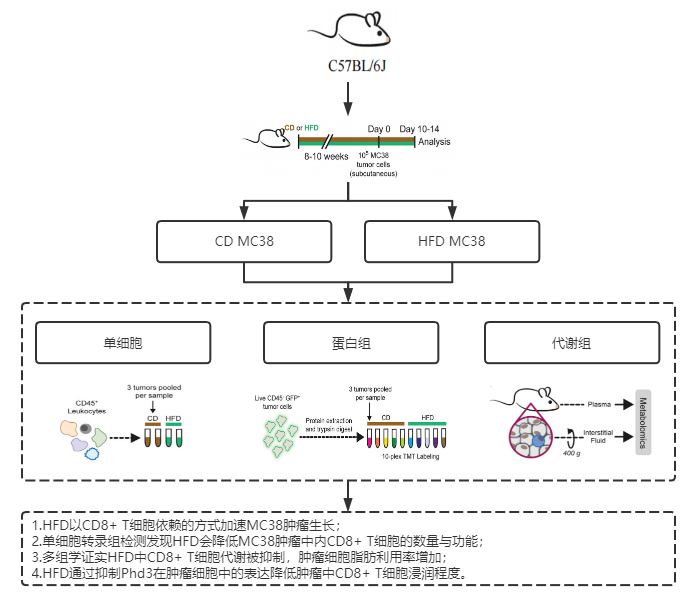
主要结果

1. HFD损害TME中的 CD8+ T 细胞功能,加速肿瘤生长
为了构建肥胖小鼠模型,作者分别为不同组别的C57BL/6J小鼠提供正常饮食(control diet,CD)和高脂肪饮食(high-fat diet,HFD),接着用不同肿瘤细胞系注射模型鼠,结果发现,与CD小鼠相比,HFD小鼠肿瘤生长得更快。
为了探究CD小鼠肿瘤生长速度的降低是否是由于 T 细胞的控制,作者在TCRα-KO(缺失 αβ T细胞)小鼠模型中注射MC38结直肠癌肿瘤细胞系,结果发现两种饮食模式下的小鼠MC38肿瘤生长速度一致。同样,在缺失 CD8+ T 细胞的小鼠模型中,肿瘤生长率也没有饮食依赖性的变化。
综上所述,这些结果提供了HFD诱导的肥胖会损害TME中的CD8+T细胞功能进而会增加MC38肿瘤生长速率的证据。


2. HFD诱导肿瘤免疫浸润的系统代谢重塑
作者还发现一个有意思的现象,在HFD小鼠中,只有TME环境中的脂肪被消耗,其他部位依然富含脂肪,这一发现促使作者进一步对TME进行单细胞层面的研究。
接下来,作者对来自 CD 和 HFD MC38 肿瘤的肿瘤浸润 CD45+ 白细胞进行单细胞转录组测序,结果发现HFD小鼠中的淋巴细胞显著减少。同时作者分析了在单细胞层面下高脂肪饮食带来的代谢变化,由于CD8+ T 细胞需要细胞间直接接触和充足的代谢资源来执行对肿瘤细胞的杀伤,而TME 中的肿瘤细胞会重新编程其代谢途径以增加脂肪的摄取,在抑制CD8+T细胞代谢的同时,促进肿瘤细胞的生长。该结果表明,HFD诱导TME中的肿瘤细胞经历独特的代谢适应以响应 HFD,进而对整个TME代谢途径重编程。


3. 多组学验证TME中肿瘤细胞和免疫细胞代谢途径的变化与饮食相关
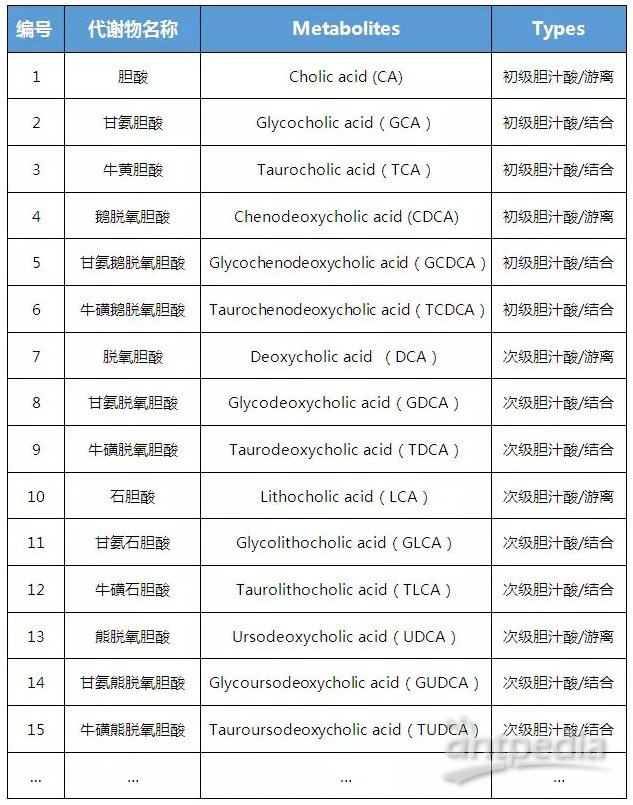
为了更深入地了解肿瘤细胞对高饮食脂肪的适应性,作者从CD 和 HFD MC38 肿瘤中分选出肿瘤细胞进行TMT蛋白组学研究,蛋白质组学分析揭示了CD8+T细胞活性的降低可能是因为 HFD 通过诱导转运蛋白 (SLC27A1)、脂肪酸结合蛋白 (FABP5) 和参与线粒体 β-氧化的蛋白质 (CPT1A、ACSM3、ACADVL、ETFB 和 ECHS1) 来支持肿瘤细胞的脂肪利用。接着利用靶向脂质组学检测HFD小鼠血浆和TME(MC38肿瘤细胞和肿瘤间质液TIF)中的脂质水平,结果表明甘油二酯(DAG)和 甘油三酯(TAG)水平是喂食 HFD 的小鼠 TME 的主要差异。所有的结果都支持 HFD MC38的肿瘤细胞重塑代谢途径以增加脂肪酸摄取和氧化。

4. 潜在的药物治疗靶点:PHD3
作者假设阻止 HFD 诱导的代谢重塑可以恢复 CD8+ T 细胞活性并防止 HFD 上肿瘤生长增加。为了验证这个想法,作者在 MC38 细胞中过表达 PHD3(MC38 细胞中 HFD 改变的主要代谢调节因子之一),发现PHD3过表达能够降低肥胖小鼠肿瘤吸收脂肪的能力,同时还恢复了TME中免疫细胞对于关键游离脂肪酸的可用性。该结果证实了肿瘤细胞中 PHD3 的过表达可以逆转HFD对肿瘤中免疫细胞功能的负面影响,并促进了免疫系统对肿瘤生长的抑制。

结论

文章确定了由饮食改变的系统代谢是肿瘤微环境中代谢途径的关键决定因素。肿瘤在代谢多样化的环境中发展,因为患者具有广泛的饮食习惯、血液化学参数、肥胖和基础代谢特性。以往的研究主要集中在与这些变量相关的肿瘤细胞内在代谢重排上。本文通过多组学方法,表明 TME 的细胞成分(例如,免疫细胞和肿瘤细胞)可以表现不同。由于脂肪酸分配的改变和必需代谢物的局部消耗,肿瘤细胞对 HFD 的适应导致 T 细胞功能障碍,这表明肿瘤内细胞的代谢状态可以耦合。这些发现突出了肿瘤内局部代谢的复杂性,并表明将肿瘤内细胞群之间的代谢互惠性视为调节对肿瘤生长的免疫控制的因素至关重要。
参考文献:
Ringel A E , Drijvers J M , Baker G J , et al. Obesity Shapes Metabolism in the Tumor Microenvironment to Suppress Anti-Tumor Immunity[J]. Cell, 2020.

中科优品推荐
【中科新生命】17年科技服务经验,多组学解决方案领航者,拥有高精尖的技术平台、专业的技术团队、顶刊青睐的单细胞多组学联合分析方案,为您的科研保驾护航。


<< 滑动查看下一张图片 >>


我知道你
在看
哦