Cancer cell | 樊嘉/周虎/高大明/高强又一力作:多组学联合绘制肝内胆管癌分子图谱

● 前言
2021年12月30日复旦大学附属中山医院樊嘉院士、中国科学院上海药物研究所周虎研究员、中国科学院分子细胞科学卓越创新中心高大明研究员、复旦大学附属中山医院高强教授课题组合作在Cancer Cell上发表题为“Proteogenomic characterization identifies clinically relevant subgroups of intrahepatic cholangiocarcinoma”的研究论文,通过基因组学、转录组学、蛋白质组学、磷酸化蛋白质组学、微生物组学研究方法对262例肝内胆管癌(iCCA)患者的配对肿瘤和癌旁组织进行了分析,通过绘制肝内胆管癌的多维分子图谱为进一步鉴定iCCA的分子发病机制、分子分型、预后等提供了宝贵的资源。

中文标题:蛋白基因组学特征确定肝内胆管癌的临床亚型
研究对象:肝内胆管癌
发表期刊:Cancer Cell
影响因子:31.743
发表时间:2021年12月30日
运用生物技术:基因组学、转录组学、蛋白质组学、磷酸化蛋白质组学、微生物组学
● 研究背景
肝内胆管癌(iCCA)是常见的原发性肝脏恶性肿瘤。多数患者发现时已是晚期,且治疗效果有限。因此迫切需要更深入地了解肝内胆管癌的发病机制以鉴定可能的治疗靶点。本文在国际癌症蛋白质基因组联盟(ICPC)的主持下,对262名中国iCCA患者进行了基因组学、转录组学、蛋白质组学、磷酸化蛋白质组学和微生物组学分析,为进一步的生理病理研究、疾病诊断和药物研发提供基础数据。
● 研究思路
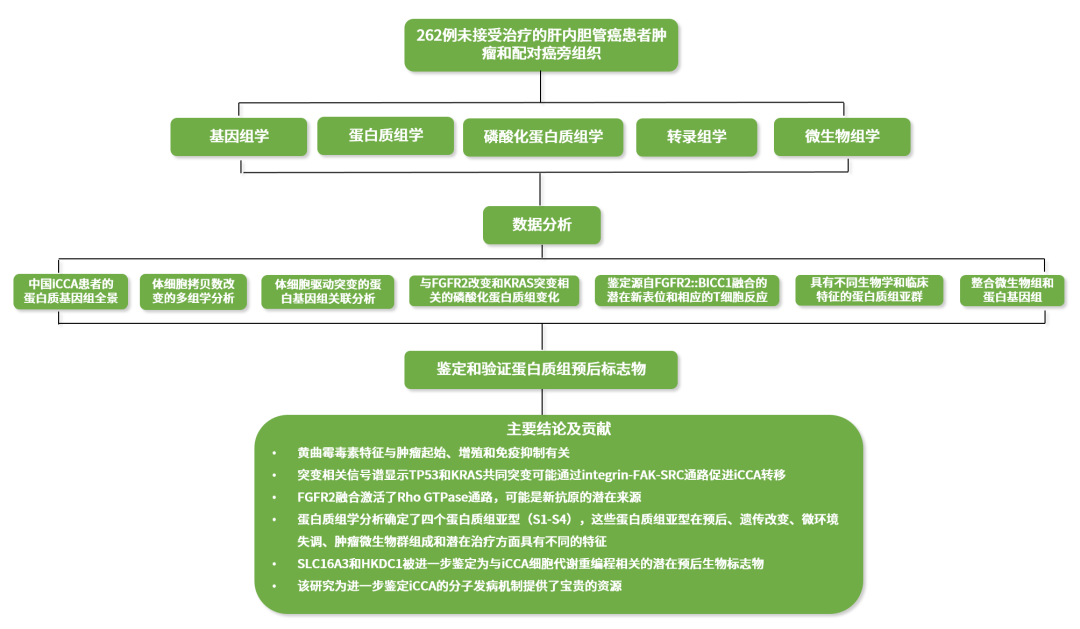
● 研究结果
1. 中国iCCA患者的蛋白质基因组全景
为了描述中国iCCA患者的蛋白质基因组特征,作者收集了262个来自前瞻性队列的未接受治疗的iCCA患者肿瘤和配对癌旁组织(FU-iCCA)。共鉴定了12,197个非同义体细胞点突变和603个插入缺失。蛋白质组定量到了10,529种蛋白质,磷酸化蛋白质组定量到了来自9,832个磷酸化蛋白的62,879个磷酸化位点。基因组确定了包括TP53、KRAS、FGFR2、IDH1/2、BAP1、ARID1A和PBRM1在内的16个显著改变的肿瘤驱动基因(图1A)。与西方iCCA人群队列相比,本文队列显示出更高的KRAS突变频率和更低的IDH1、ARID1A和TERT突变频率(图1B)。在FU-iCCA队列中观察到黄曲霉毒素和马兜铃酸特征(图1C)。通过比较具有或不具有黄曲霉毒素特征的所有肿瘤的多组学数据,发现具有黄曲霉毒素特征的肿瘤显示出DNA修复和细胞周期通路的上调以及细胞凋亡、感染炎症和免疫通路的下调(图1E)。进一步分析显示,TP53突变与黄曲霉毒素特征显著相关(图1F和1G)。


图1 | FU-iCCA队列的基因组图谱
2.体细胞拷贝数改变的多组学分析
总共有39.3%(101/253)的FU-iCCA存在至少一种基因改变,其中包含61例突变,9例TMB高,32例融合和4例扩增。这些拷贝数改变(CNAs)对mRNA、蛋白质和磷酸化蛋白丰度具有顺式和反式影响(图2A)。对于mRNA、蛋白质和磷酸化蛋白,总共观察到3,981、1,081和408个显著的顺式相关性,3个组学中只有194个共同的显著顺式影响(图2B)。总共有963种蛋白质同时表现出CNA-mRNA和CNA-蛋白质顺式效应,它们主要富集在代谢、生物合成和蛋白质加工通路中(图2C)。值得注意的是,14q丢失显示出与蛋白质组和转录组丰度的不同相关性(图2E),表明这些区域存在潜在的蛋白质水平调节。对于蛋白质丰度随着14q丢失而增加的585个基因,富集到了剪接体、错配修复、DNA复制、细胞周期和代谢的通路(图2F)。此外,14q丢失分别显示对蛋白酶体基因和细胞周期调节子的蛋白表达水平的顺式和反式影响(图2G)。总而言之,14q丢失相关的全局顺式和反式相关性可能为iCCA肿瘤发生提供机制基础(图2H)。



图2 | 拷贝数改变对mRNA和蛋白质丰度的影响
3.体细胞驱动突变的蛋白基因组关联分析
作者分析了体细胞驱动突变对蛋白质和磷酸化蛋白丰度的影响,发现了四个最显著的驱动突变(TP53、KRAS、IDH1/2和BAP1)。TP53突变与细胞周期、药物代谢、吞噬体和碳代谢通路的上调以及ECM-粘着斑、PI3K-AKT和Hippo-YAP信号通路的下调有关(图3A)。KRAS突变与炎症感染和ECM-粘着斑通路中蛋白质的增加以及细胞周期通路中的蛋白质减少有关(图3B)。有趣的是,本文队列中有10例iCCA患者携带TP53和KRAS共突变,其生存率明显低于TP53或KRAS单突变患者(图3C)。与TP53、KRAS单突变或不突变相比,TP53或KRAS双突变的肿瘤中细胞粘附相关分子高表达(图3D和3E)。进一步分析表明,ECM和胆汁分泌通路在BAP1突变肿瘤和IDH1/2突变肿瘤中都相互激活,而吞噬体、炎症和MAPK通路仅在它们中的其中一个相对活跃(图3G、3H)。


图3 | 驱动突变对蛋白基因组的影响
4.与FGFR2改变和KRAS突变相关的磷酸化蛋白质组变化
iCCA中增强的FGFR2信号传导由突变和染色体易位介导。本文结果表明所有FGFR2突变都位于激酶域之外(图4A)。在11.9%的FU-iCCA中发现的FGFR2融合主要是由含有二聚化结构域的融合配偶体产生的,以诱导配体非依赖性受体二聚化。这些融合通过荧光原位杂交进行了验证(图4C),几乎所有具有FGFR2融合的肿瘤细胞都显示出分离的探针信号,表明FGFR2融合是iCCA中的早期克隆事件。由于FGFR2改变和KRAS突变可能影响MAPK、PI3K-AKT-mTOR和Rho GTPase通路,作者探索了有无这些改变的肿瘤中磷酸化位点和蛋白丰度的区别(图4D)。KRAS突变的肿瘤显示出MAPK通路的级联激活。而Rho GTPase通路在FGFR2改变的肿瘤中显著上调(图4E)。此外,FGFR2改变的肿瘤在PTPN11的Y62和TLN1的Y70位点上显示出显著的酪氨酸磷酸化(图4F)。热图显示FGFR2和PTPN11蛋白以及PTPN11 Y62磷酸化同时上调(图4G)。


图4 | FGFR2改变和KRAS突变对蛋白基因组的影响
5.鉴定源自FGFR2::BICC1融合的潜在新表位和相应的T细胞反应
基因融合可以产生用于个性化免疫治疗的新肽候选物。对于FGFR2::BICC1融合蛋白,使用跨越断点残基的序列(DLDRILTLTTNEIMEETNTQI和DLDRILTLTTNEGSSMSLSRS)构建序列数据库(图5A)。通过四聚体交换测定,一部分合成肽成功地交换到HLA-A02:01和HLA-A24:02四聚体(图5B)。来自健康供体的T细胞可能提供丰富的T细胞库,可以特异性识别肿瘤上呈现的新抗原。来自三个健康供体的外周血单核细胞(PBMC)与上述融合肽共培养,发现供体1和2的PBMC与肽32和33共培养时IFN-g分泌显著上调(图5B)。接下来,使用肽32和33刺激来自供体1和2的PBMC 7天,然后通过CyTOF和TCR测序。CyTOF数据显示,T细胞的表型随着肽刺激而进化(图5C)。伪时间分析显示,T细胞向激活发展,然后分叉成memory和exhausted的分支,代表成熟后期的两个谱系(图5D)。Morisita-Horn指数(图 5E)证实了供体2中肽32刺激后TCR库的重排(图5F)。尽管供体间存在异质性,但新表位T细胞反应性的低频率代表了克服iCCA融合患者的免疫编辑和耐药性的宝贵外部资源。


图5|大黄素抑制 SAP 期间胰腺外泌体的分泌
鉴定源自FGFR2:BICC1融合的潜在新表位及其新表位反应性T细胞表型
6.具有不同生物学和临床特征的蛋白质组亚群
作者使用变化最大的1,376种蛋白质进行聚类(图6A),鉴定了4个不同的蛋白质组亚型(S1-S4),这些亚型具有不同的临床、基因组、免疫学和微环境特征。S1展现出丰富的炎症蛋白表现,例如CD14、MPO和C5AR1。S2具有最高水平的癌症相关成纤维细胞和ECM相关的蛋白质,包括FAP、POSTN和FLT1。S3的特点是MAPK和代谢蛋白升高,例如ACAT1、FASN和IDH1。S4保留了粘附和胆道特异性蛋白的最大表达,例如ANXA4、KRT18和EPCAM(图6B)。
临床指标中,S1亚型患者CA19-9、肿瘤坏死和肝内转移水平升高。S2亚型患者有较高的淋巴结转移。S3亚型患者以HBV感染为特征。S4亚型富集了低水平CA19-9和较少转移的患者。四个蛋白质组亚型的总生存期(OS)存在显著差异,S1-S4的中位生存期分别为17.2、25.3、36.7和>60个月(图6C)。多因素Cox分析证实蛋白质组学亚型是独立预后因子。重要的是,对于TNM早期阶段的患者,蛋白质组学亚型同样可以对患者的生存率进行分层(独立于CA19-9和CEA水平)(图6C)。此外,作者发现其蛋白质组学亚型与之前报道的胆管癌分子亚型之间存在相当的重叠[1]。
每个亚型显示出反复改变基因的不同图谱(图6D)。KRAS突变在S1中显著富集,同时炎症通路上调。TP53突变在S3中占主导地位,伴随着富集的细胞周期和MAPK信号通路。FGFR2改变、BAP1突变和IDH1/2突变在S4中最常见,部分与胆汁分泌升高一致。基于xCell分析,S1以中性粒细胞、单核细胞、巨噬细胞、树突状、Th2和Treg浸润为主,其中大部分可能与免疫抑制有关(图6E)。S2显示出最高强度的成纤维细胞和内皮细胞,基质评分和血管生成评分增加。S4具有最丰富的嗜碱性粒细胞和CD8+ naive T细胞。免疫检查点也表现出亚型特异性模式,S1中IDO、CEACAM1、CD47、VSIG4和CD274升高,S2中CD276、CD40和NT5E升高,S4中VTCN1、HMGB1和PVRL2升高,显示出通过蛋白质组学分层获得潜在的免疫治疗益处。
作者从四个亚型中筛选了各自的特异性标志物,分别是MPO(中性粒细胞)、POSTN(成纤维细胞)、ALDOB(代谢)和EPCAM(胆管)(图6F)。在FU-iCCA队列(n = 84)和验证队列(n = 144)中,4种标志物的多重免疫染色可以对患者生存进行分层(图6G)。此外通过mRNA和磷酸化蛋白的聚类,作者分别鉴定了三个转录组亚型和三个磷酸化蛋白质组亚型,不同亚型间的患者具有显著的预后差异。转录组学和磷酸化蛋白质组学亚型与蛋白质组亚型有部分重叠,具有不同的分子特征。
接着作者分析了15个iCCA细胞系的蛋白基因组,发现3个细胞系与S1一致,5个与S2一致,4个与S3一致,3个与S4一致。对其中的10种细胞系进行高通量药物筛选,结果发现大多数细胞系对一线铂类药物普遍耐药,而吉西他滨和紫杉醇对S1和S3除外的大多数细胞系敏感。拓扑异构酶I/II抑制剂和微管相关抑制剂对所有亚型都广谱抗iCCA活性。此外,S1和S2对EGFR抑制剂的敏感性高于S3和S4。这些数据表明不同的亚型患者具有不同的药物反应,可能需要针对亚型的治疗。



图6 | FU-iCCA队列的蛋白质组学分层和相应的分子和通路特征
7.鉴定和验证蛋白质组预后标志物
作者通过监督分析鉴定了19种良好预后相关蛋白质和15种不良预后相关蛋白质(图7A)。其中,HKDC1是最显著的预后正相关蛋白,SLC16A3是最显著的预后负相关蛋白(图7B)。这两种蛋白的丰度在四个蛋白质组亚型中也存在显著差异,SLC16A3在S1中上调,HKDC1在S4中升高(图7C)。
在另一个独立的iCCA队列(图7D,n = 222)中,免疫染色结果表明HKDC1低表达和SLC16A3的高表达预示着不良预后,进一步确认了其预后价值。本文数据表明HKDC1可能在iCCA中充当肿瘤抑制因子。实验发现HKDC1的过表达降低了HuCCT1细胞的细胞增殖、集落形成、葡萄糖消耗和糖酵解能力,支持其在iCCA细胞中的抗糖酵解/增殖作用(图7E、7G)。而过表达SLC16A3的HuCCT1细胞表现出更快的增殖和更高的集落形成(图7F),这可能是由于更有效的糖酵解能力(图7H)。SLC16A3敲低显著降低了HuCCT1细胞增殖、集落形成和糖酵解能力。因此,SLC16A3主要通过促进糖酵解代谢在iCCA中发挥致癌因子的作用。



图7 | 鉴定和验证蛋白质组预后标志物
8.整合微生物组和蛋白基因组
为了研究iCCA组织细菌与癌症进展之间的潜在关系,作者从4个蛋白质组亚型中随机且均等地选择了80对iCCA肿瘤和癌旁样本,并进行了16S rRNA测序。肿瘤微生物α多样性分析显示α多样性从S1到S4呈下降趋势。然而,肿瘤和癌旁组织之间的微生物α多样性没有显著差异。进一步的分析表明,肿瘤微生物群落在每个亚型中呈现出系统发育接近性。在4个亚型中,共有12个属具有丰度上的差异。因此,四个蛋白质组亚型具有不同的肿瘤微生物群多样性、组成和功能,可能在免疫和代谢重塑中发挥重要作用。
● 研究结论
基因组学、转录组学、蛋白质组学、磷酸化蛋白质组学和微生物组学数据的整合分析鉴定了分子机制和疾病亚型,这些信息单独从基因组和转录组是无法完全捕获的。本文数据可能为开发个性化靶向药物和免疫疗法开辟新途径,为深入研究iCCA的致癌、进展和治疗提供宝贵资源。
小鹿推荐
随着美国临床蛋白质组肿瘤分析项目(CPTAC)和中国人类蛋白质组计划(CNHPP)等大型蛋白质组学研究计划的推进,发表了一系列肿瘤的大规模人群多组学分析文章[2,3]。这些高分文章通过基因组学、转录组学、蛋白质组学、磷酸化蛋白质组学、代谢组学、微生物组学等技术,在上百例的病例样本中全面表征了某种肿瘤的分子特征。对比这些文章,可以发现蛋白质组学数据在多组学数据分析中逐渐成为核心结果,且蛋白质组学数据分析有些共同特点,即:
1) 基于蛋白质组进行肿瘤分子分型
2) 分析不同亚型患者的临床特征
3) 免疫、代谢、突变、微生物等肿瘤领域研究热点在不同亚型中的差别分析
4) 筛选亚型特征分子作为预后标志物或潜在的药靶进行验证或机制研究
该文是樊嘉院士/周虎研究员/高大明研究员/高强教授团队继2019年Cell发表的肝细胞癌多组学研究后,同样基于蛋白质组为核心的多组学联合分析策略,进一步阐释了蛋白质组学驱动精准医学的优势,为肿瘤的发生发展机制、分子分型、预后监测和个性化治疗策略提供新思路。
参考文献 (选填)
[1] Job, S., Rapoud, D., Dos Santos, A., Gonzalez, P., Desterke, C., Pascal, G., Elarouci, N., Ayadi, M., Adam, R., Azoulay, D., et al. (2019). Identification of four immune subtypes characterized by distinct composition and functions of tumor microenvironment in intrahepatic cholangiocarcinoma. Hepatology 72, 965–981.
[2] Jiang, Y., Sun, A., Zhao, Y., Ying, W., Sun, H., Yang, X., Xing, B., Sun, W., Ren, L., Hu, B., et al. (2019). Proteomics identifies new therapeutic targets of early stage hepatocellular carcinoma. Nature 567, 257–261.
[3] Gao, Q., Zhu, H., Dong, L., Shi, W., Chen, R., Song, Z., Huang, C., Li, J., Dong, X., Zhou, Y., et al. (2019). Integrated proteogenomic characterization of HBV-related hepatocellular carcinoma. Cell 179, 561–577.e22.
文末看点 | lumingbio
鹿明生物一直专注于生命科学和生命技术领域,是国内早期开展蛋白质组研究的团队,特别是tims TOF Pro 4D蛋白质组质谱平台的引进,大幅提高的质谱平台的性能,更高的重复性、稳定性和灵敏度,以及更快的扫描速度为大队列研究提供了坚实的保障。


长按扫码咨询鹿明生物
技术工程师
项目咨询|样本咨询
猜你还想看
END
云起 撰文
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点“阅读原文”了解更多