复杂融合蛋白O-糖基化表征策略

糖基化是一种常见的蛋白药物翻译后修饰(PTM),在抗体关键质量属性中起着重要作用【1】。生物制品中N-和O-糖基化的深度表征对于确保药物安全性和有效性至关重要【1】。当应用于糖肽时,传统的基于碰撞的MS/MS方法,如碰撞诱导解离(CID),会导致不稳定聚糖部分的丢失。因此,使用CID精确测定糖基化位点极具挑战性,尤其是对于没有共有序列的O-糖基化。与CID相比,电子活化解离(EAD)在糖肽分析方面具有优势,因为它能够保存片段中的聚糖结构。依那西普是一种二聚体融合蛋白,由两条肿瘤坏死因子受体(TNFR)-Fc链组成,每条链上有3个N-糖基化和13个O-糖基化位点,本文将详细阐述EAD在糖肽水平上分析O-糖基化信息,采用EAD DDA或MRMHR方法来表征去乙酰化依那西普的复杂O-糖基化特征。【2-4】。

SCIEX基于糖基化深度表征方案的特点:
01
EAD 准确鉴定糖基化位点:不稳定聚糖可以保留在EAD碎裂片段中,可准确鉴定糖基化位点,并可靠区分O-糖肽的位置异构体。
02
卓越的灵敏度和高质量的MS/MS数据:ZenoTOF 7600系统的Zeno阱可将MS/MS碎片的灵敏度提高5-10倍,从而实现卓越的MS/MS灵敏度和谱图质量。
03
快速灵活:EAD可在数据依赖采集(DDA)或高分辨定量(MRMHR)模式下运行,具有快速扫描速率(DDA模式下约20 Hz)和可调整电子动能(0-25eV)的能力。
04
强大的数据分析平台:Biologics Explorer软件为肽图和PTM分析提供了强大、直观的分析能力。
含1个O-糖的糖肽
图1显示了两种胰蛋白酶酶切的O-糖肽(L1-R19和T243-K268)的EAD谱图,它们含有一个核心聚糖结构(HexNAcHex)。两个肽段都含有3个潜在的O-糖基化位点(2个Thr和1个Ser),但只有一个位点被HexNAcHex修饰。如图2所示,EAD产生了质量优异的MS/MS碎片信息,具有几乎完整的c/y/z片段序列,可以对这两种O-糖肽的进行可靠鉴定和聚糖的准确定位。具体而言,基于c7/c9和y11/z12片段的m/z,肽段L1-R19(图1A)中的O-糖基化位点被确定为T8,而基于检测到非糖基化c2/y23片段和包含糖基化的c3/y24/z24片段,肽段T243-268(图1B)中的T245被HexNAcHex修饰。
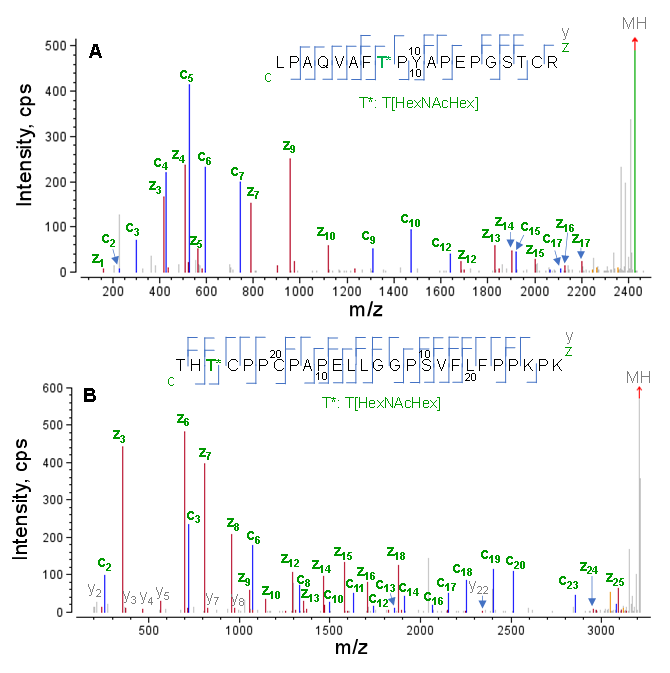
点击查看大图
图1. 单O-糖基化肽段L1-R19(A)和T243-K268(B)的EAD谱图(1eV)。两种胰蛋白酶切肽段含有多个可能的O-糖基化位点(Ser和Thr),其中一个被核心聚糖结构(HexNAcHex)修饰。优异的EAD MS/MS谱图允许O-糖在肽段L1-R19(A)中的T8处和肽段T243-K268(B)中的T245处可靠定位。
含多个O-糖的糖肽
依那西普的胰蛋白酶酶切产生的长肽段(S202-K238),其包含11个潜在的O-糖基化位点(6个Ser和5个Thr),EAD数据证实11个位点中有7个被O-糖占据。图2显示了含有6或7个HexNAcHex的EAD MS/MS谱图。多个脯氨酸残基(总共9个)的存在阻止了对应于脯氨酸N端裂解的c/z片段的产生。通过在KE=7eV时检测额外的a/y片段,部分克服了这一限制。通过考虑所有碎片离子(c/z/a/y),可以确定序列中6或7个HexNAcHex的位置(图2)。

点击查看大图
图2. 用6(A)或7(B)HexNAcHex修饰的O-糖肽S202-K238的EAD MS/MS谱图(7 eV)。O-糖肽S202-K308含有多达7个O-聚糖,使用EAD对含有6(A)或7(B)HexNAcHex的物种实现了O-糖的准确定位。请注意,图2A显示了含有6 HexHAcHex的两种位置异构体之一的EAD MS/MS谱图,两种异构体的区别见图3。
我们观察到糖肽S202-K238的两种位置异构体,其含有6个HexNAcHex部分。图3显示了特征EAD片段,即用于区分这两种异构体的双电荷c11、c12和c15。从两种异构体的EAD产生的c12的m/z差异(365 Da)表明,T213(序列中的T12)在异构体1中被O-糖基化(图3B),但在异构体2中没有(图3E)。两种异构体的c15的m/z相同的事实表明,S216(序列中的S16)在异构体2中被HexNAcHex修饰(图3F),但在异构体1中未被糖基化(图3C)。这些结果证明了EAD在正确区分位置异构体方面的能力,这对传统的基于碰撞的MS/MS方法(如CID)是无法完成的。
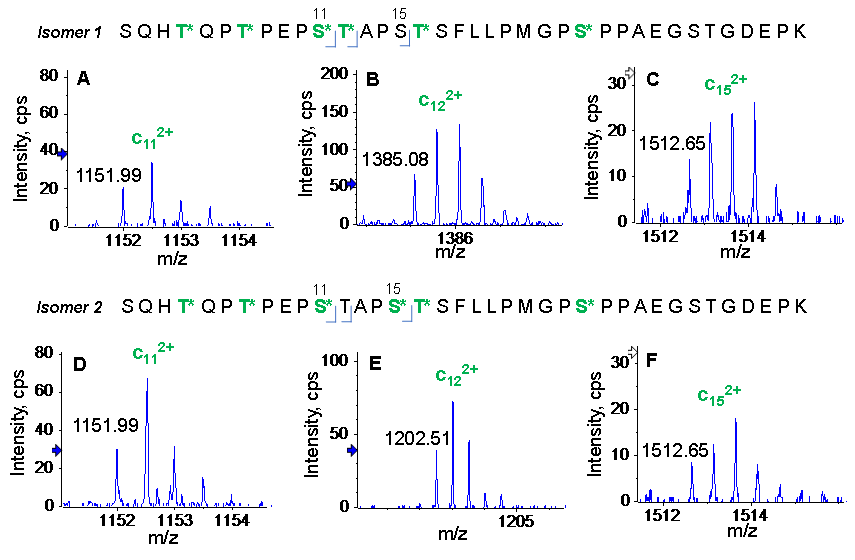
点击查看大图
图3. 区分含6个HexNAcHex O-糖肽S202-K238的两种位置异构体的特征c离子。两种异构体(异构体1和异构体2)分别基于在相同m/z下检测c112+和c152+离子(A和D)和包含异构体1(B)和异构体3(E)的4个和3个 HexNAcHex的c122+片段来区分。c122+的m/z表明,序列中的T12在异构体1(B)中被HexNAcHex修饰,但在异构体2(E)中没有,其中基于c152+(F)的m/z信息,S15被糖基化。
■ 总结
1. 准确鉴定和精准定位依那西普的O糖基化信息。
2. 高质量EAD数据能够定位含有多达7个O糖位点的O-糖肽。
3. O-糖肽的位置异构体基于EAD中产生的完整或接近完整的序列离子系列进行明确区分。
4. EAD方法可用于阐明蛋白药物治疗中的复杂糖基化谱图信息。

扫码查看原文
References
1. Zhang P et al. (2016) Challenges of glycosylation analysis and control: an integrated approach to producing optimal and consistent therapeutic drugs. Drug Discovery Today 21(5): 740-765.
2. A new electron activated dissociation (EAD) approach for comprehensive glycopeptide analysis of therapeutic proteins. SCIEX technical note, RUO-MKT-02-12980-A.
3. Comprehensive glycopeptide analysis of a protein-based vaccine. SCIEX technical note, RUO-MKT-02-13816-A.
4. Site-specific N-linked glycan profiling on the fusion protein aflibercept using a novel fragmentation technique. SCIEX technical note, RUO-MKT-02-14145-A.

声明:版权为 SCIEX 所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权, 转载时须注明「来源:SCIEX」。申请授权转载请在该文章下“写留言”。


喜欢就点在看哟