项目文章STTT | 复旦大学利用Labelfree蛋白组学技术解析抗精神病药物的心脏毒性机制

长期使用抗精神病药物是导致心肌损伤甚至心脏性猝死的常见原因,常常导致停药或治疗不连续。但是抗精神病药物对心脏产生毒性的机制很大程度上仍然是未知的。
2022年6月,复旦大学遗传工程国家重点实验室金力院士与复旦大学附属中山医院邹云增教授及复旦大学基础医学院李立亮副教授团队合作,在Nature旗下Signal Transduction and Targeted Therapy(IF 38.104)杂志上发表了题为“CB1R-stabilized NLRP3 inflammasome drives antipsychotics cardiotoxicity”的研究论文,该文章利用Labelfree蛋白组学、RNA测序等方法发现NLRP3 炎症小体介导的细胞焦亡主要与多种抗精神病药物的心脏毒性有关,且发现大麻素受体 1 (CB1R) 是NLRP3 炎性体的上游调节剂。此外,筛选到了安全、低毒的CB1R拮抗剂作为药物毒性的联合治疗策略。中科新生命为该研究提供了Labelfree蛋白组学技术服务。

研究材料
小鼠心肌细胞、基因敲除小鼠、人心脏组织
技术路线
步骤1:抗精神病药 (AP) 早期可引起心脏毒性;
步骤2:多种AP药物激活NLRP3炎症小体,诱导心肌细胞焦亡;
步骤3:NLRP3炎症小体介导的焦亡与AP药物的心脏毒性密切相关;
步骤4:CB1R是AP药物的直接靶点,对NLRP3炎性小体起重要调控作用;
步骤5:CB1R通过177-209氨基酸残基与NLRP3炎症小体相互作用并阻止其降解;
步骤6:Cb1r基因敲除改善AP药物诱导的焦亡和心脏毒性;
步骤7:CB1R抑制剂保护小鼠免受AP药物的心脏毒性而不引起额外的副作用;
步骤8:在人心脏标本中,CB1R的表达与AP药物诱导的焦亡和纤维化程度呈正相关。
研究结果
1. 表型分析:抗精神病药 (AP) 早期可引起心脏毒性
研究人员首先使用抗精神病药奥氮平(Olz)_对小鼠进行日常治疗,然后进行多器官毒性评估,结果发现随着抗精神病药给药时间延长,AP药物在心脏中出现了明显的蓄积,且AP药物引起的心脏毒性比糖脂代谢紊乱或其他功能障碍的发生更早出现。

图1 抗精神病药对心脏的毒性作用
2. 机制分析(转录组学):多种AP药物激活NLRP3炎症小体,诱导心肌细胞焦亡
接下来研究人员对Olz处理后的心脏进行RNA测序,结果发现GO富集分析中程序性细胞死亡途径,特别是炎症体介导的细胞焦亡显著富集。WB等实验发现NLRP3炎性小体(由ASC、Caspase-1和NLRP3组成的复合体)和促炎因子(IL-1β、IL-18等)的蛋白水平以Olz剂量和时间依赖性的方式显著增强。其他两种AP药物氯氮平(Clz) 和喹硫平(Que)与Olz发挥了相同的作用,也会导致促炎因子的的分泌和焦亡蛋白的表达。此外通过敲除焦亡基因或加入NLRP3炎症小体抑制剂等方式,研究人员确定NLRP3炎性小体参与AP药物诱导的焦亡且焦亡在AP药物细胞毒性中的特异性。

图2 AP药物激活NLRP3炎症小体,诱导心肌细胞焦亡
3. 功能验证:NLRP3炎症小体介导的焦亡与AP药物的心脏毒性密切相关
为了评估NLRP3炎性小体介导的心力衰竭是否与AP药物诱导的心脏毒性作用有功能关联,作者使用NLRP3抑制剂/Casp1抑制剂发现其限制了炎症反应和心脏的纤维化。焦亡效应基因GSDMD的敲除实验也减少了炎症浸润和纤维化。综上表明NLRP3炎症小体介导的焦亡与AP药物的心脏毒性密切相关。
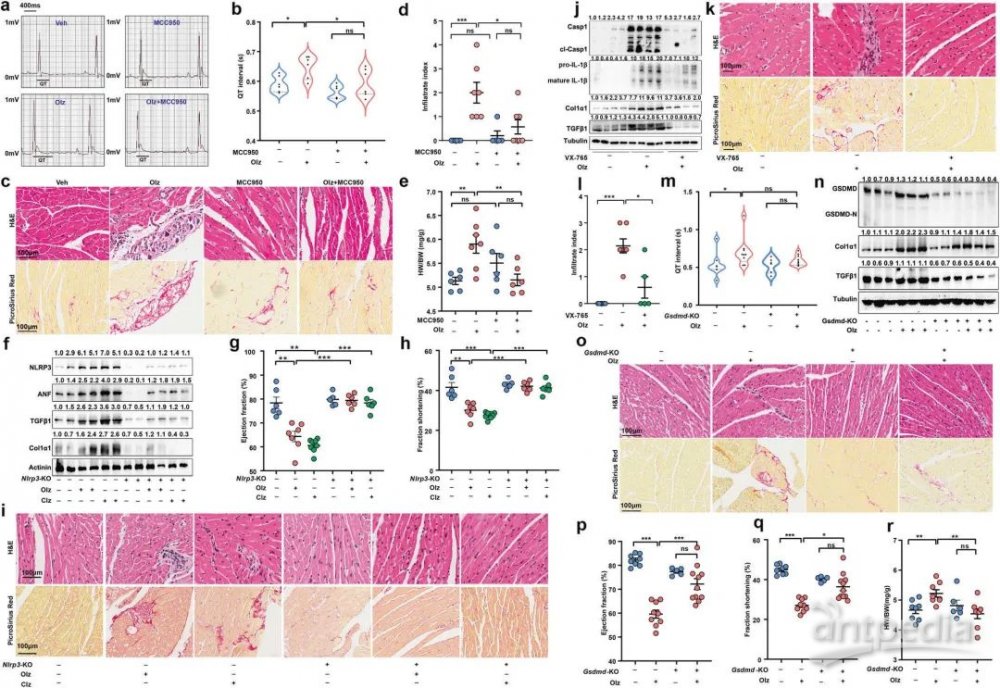
图3 NLRP3炎症小体介导的焦亡与AP药物的心脏毒性密切相关
4. 机制解析(药物靶标蛋白):CB1R是AP药物的直接靶点,对NLRP3炎性小体起重要调控作用
为了揭示AP药物激活焦亡的主要机制,研究人员分别进行了转录组和蛋白质组的分析及联合分析。根据联合分析中共有的9条通路分别加入不同的抑制剂处理,结果发现内源性大麻素对于Olz诱导的NLRP3炎症小体的表达具有显著的抑制效果。而大麻素受体1 (Cannabinoid receptor 1, Cb1r)是内源性大麻素的受体,故作者进一步验证了CB1R是否为AP药物的直接靶点。结果表明在Olz、Clz或Que暴露的小鼠原代心肌细胞中CB1R的表达均被促进,且 AP药物(Olz和Clz)可直接结合CB1R,并与主要的内源性大麻素(2-AG和AEA)在与CB1R结合时存在竞争结合模式。此外,研究发现AP药物与CB1R结合后,通过CB1R的 S426或S430位点磷酸化而促进了CB1R由膜转位至胞浆(内化)。另外研究发现,CB1R的过表达增强了NLRP3炎症小体蛋白的表达。综上所述,CB1R是NLRP3炎性小体的上游调节剂。

图4 CB1R是AP药物的直接靶点,且是NLRP3炎性小体的上游调节剂
5. 机制解析(上下游蛋白的互作分析):CB1R通过177-209氨基酸残基与NLRP3炎症小体相互作用并阻止其降解
为研究CB1R是否影响焦亡蛋白的合成或降解,作者使用蛋白质合成抑制剂环己酰亚胺(CHX)并结合CB1R的过表达或敲除进行研究,结果表明CB1R通过抑制NLRP3炎症小体的降解来稳定NLRP3炎症小体。此外,通过免疫共沉淀实验证实除ASC外,CB1R与NLRP3、Casp1和GSDMD存在直接的物理相互作用,结合区域为CB1R的177-209氨基酸残基。综上所述,CB1R内化后通过与NLRP3炎症小体主要成分直接相互作用稳定了NLRP3炎症小体。

图5 CB1R通过177-209氨基酸残基与NLRP3炎症小体相互作用并阻止其降解
6. 功能验证:Cb1r基因敲除改善AP药物诱导的焦亡和心脏毒性
为验证CB1R在AP药物诱导的焦亡和心脏毒性中的作用,作者将Cb1r基因敲除,研究发现Olz和Clz刺激后,Cb1r敲除小鼠表现为正常心功能,未表现出心脏重塑、纤维化组织积累等。而当Cb1r基因过表达时,则相反。

图6 Cb1r基因敲除改善AP药物诱导的焦亡和心脏毒性
7. 药物筛选:CB1R抑制剂保护小鼠免受AP药物的心脏毒性而不引起额外的副作用
为探究CB1R抑制剂在小鼠模型中的保护心脏的能力,作者检测了CB1R拮抗剂AM251和AM281的体内治疗效果。结果发现AM251或AM281处理小鼠后,炎症小体数量明显减少、活性受损、抑制了焦亡蛋白和纤维因子,同时心脏功能也得到了改善,此外也未引起额外的副作用。综上所述AM 251和AM 281可能在保护心脏免受抗精神病药物心脏毒性方面发挥更安全的作用。

图7 CB1R抑制剂保护小鼠免受AP药物的心脏毒性而不引起额外的副作用
8. 临床验证:在人心脏标本中,CB1R的表达与AP药物诱导的焦亡和纤维化程度呈正相关
最后作者在人心脏标本中评估了CB1R调节NLRP3炎性小体的临床转化潜能。在真实的尸检病例中,长期使用Clz或Olz的患者心脏中,有显著的NLRP3炎性小体斑点、大量纤维组织积累,且NLRP3炎性小体斑点的数量或GSDMD表达量与心脏纤维化程度显著相关、CB1R表达与纤维化程度、NLRP3炎性小体数目和GSDMD表达也具有良好的相关性。综上所述, CB1R的异常表达与抗精神病药物诱导的人类心脏细胞焦亡和纤维化相关。

图8 人类心脏标本中,CB1R表达与抗精神病药物诱导的的焦亡和纤维化正相关
小编小结
本研究发现NLRP3炎性小体介导的焦亡是AP药物诱发心脏毒性的主要因素。NLRP3炎性小体的活性受CB1R控制,CB1R通过S426和S430内化,并通过其177-209区域与NLRP3炎性小体发生物理相互作用,导致NLRP3炎性小体稳定,并激活细胞焦亡,最终导致AP药物的心脏毒性。此外,实验证实CB1R的抑制剂可保护小鼠免受AP药物的心脏毒性且不引起额外的副作用。


中科优品推荐
【中科新生命】提供多元化的蛋白质组学技术服务,包含了Labelfree、TMT、DIA、4D蛋白质组、外泌体蛋白质组、血液蛋白质组、单细胞蛋白质组等。现在TMT蛋白质组更是在火热促销中,欢迎老师前来咨询。



我知道你
在看
哦