Blood | 血液学一区,4D蛋白质组学探究急性髓系白血病的蛋白质组和磷酸化组图谱~

尽管蛋白质是细胞过程的主要效应物,但通常仅通过转录组学分析太片面。然而,有研究已经反复表明,在许多癌症中信使RNA(mRNA)表达与蛋白质表达之间的关系只是近似。此外,磷酸化蛋白质组提供了转录组不可见的活性信号通路信息。在急性髓系白血病(AML)中,基因组和转录组已被广泛表征;对蛋白质组和磷酸化蛋白质组的研究有限。因此本篇对44个原发性AML骨髓样本的蛋白质组和磷酸化蛋白质组进行了深入研究,并为探索这类疾病提供了一个数据互动平台。
2022年9月,华盛顿大学圣路易斯医学院在Blood(IF:25.476)上发表的题为“Proteomic and phosphoproteomic landscapes of acute myeloid leukemia ”的研究成果,本篇运用4D蛋白组学、TMT标记定量蛋白质组学、磷酸化蛋白质组学、Western blotting等研究从LAML TCGA数据集的44名有代表性急性髓系白血病(AML)患者和6个健康的骨髓来源对照组中开发了一个深度蛋白质组和磷酸化蛋白质组数据库。在确认数据质量后,验证了蛋白质组学数据揭示的几个以前未描述的AML特征。这个公开可用的数据库可作为进一步研究AML发病机制中蛋白质失调的基础。

研究思路

研究结果
1. 深层AML蛋白质组研究
作者运用LAML TCGA样本集,从44个完全特征化的AML骨髓样本中获得了蛋白质提取物,这些样本代表了广泛的AML亚型,跨越了细胞遗传风险、常见突变和驱动融合的范围(图1)。随后对44名患者样本以及3份健康对照骨髓样本进行了label-free(LFQ)和TMT标记定量蛋白质组学研究。由于AML细胞含有丰富、高活性的丝氨酸蛋白酶,因此对样品制备进行了优化,加入了DFP蛋白酶抑制剂以避免蛋白水解。在TMT数据集中检测到10651种蛋白质,在LFQ数据集中检测到6845种蛋白质,总体上看蛋白质组学数据集的质量和可重复性都很高,为相关研究提供了可靠的蛋白数据库参考。

图1 | 研究中AML患者的特征和数据质量
2. AML蛋白质组学前景的全球分析
作者根据TMT标记蛋白质组学平台上测量的蛋白质丰度对样品进行了无监督的分层聚类,发现样本主要由重要的临床协变量组成,包括细胞遗传学或常见突变(图2A)。使用LFQ数据比较所有44个AML样品中的总体蛋白质与RNA表达,看到了许多转录后调节的例子,其中RNA丰度不能预测蛋白质丰度(图2B),比如组蛋白STMN2,AKT共激活因子/癌基因TCL1A和蛋白酪氨酸激酶受体KDR都显示出与RNA表达不成比例的显著增加的蛋白质丰度。与健康对照骨髓相比,AML样品中多个蛋白质家族丰富,mRNA丰度没有相应的变化,包括H/ACA盒小核仁核糖核蛋白核心复合物(参与mRNA34的端粒维持和假尿苷化)以及THO复合物(参与信使核糖核颗粒35的形成和输出)。

图2 | 蛋白表达水平通常与临床特征相关,并揭示转录后调节的证据
3. IDH1/2突变与KDM4A/B/C 组蛋白去甲基化酶丰度增加有关
作者对IDH1(n=5)或IDH2(n=4)突变患者与其他AML样本(n=35)进行比较,筛选出17种差异丰度有差异的蛋白质(13种在IDH突变患者中丰度增加),并注意到2-氧戊二酸依赖性H3K9/27/36组蛋白去甲基化酶KDM4A,KDM4B和KDM4C36都受到类似的影响(图3A)。在TMT数据集中,IDH1和IDH2突变的样本普遍存在丰度增加的趋势,但对IDH1的影响最强(图3B)。尽管在灵敏度较低的LFQ数据集中对这些蛋白的检测是有限的,但也出现了类似的趋势,在IDH1和IDH2突变体样本中,KDM4B的丰度明显高于IDH1/2野生型(wt)样本(在LFQ中,44个样本中只有3个检测到KDM4A,其中2个是IDH1/2突变体样本;KDM4C没有用LFQ检测到)。但是在mRNA丰度上没有看到明显的变化,这表明KDM4A/B/C的蛋白丰度是在转录后水平上控制的。

图3 | 具有IDH1/2突变的 AML 样本与 KDM4A/B/C 组蛋白去甲基化酶丰度增加有关
4. 突变的NPMc蛋白与几种核导入蛋白的丰度增加(以及与之的物理相互作用)有关
作者接下来确定了具有突变体NPM1的样本中不同的蛋白质丰度。在这个数据集中,NPMc突变存在于8个案例中,并导致NPM1在细胞质中的异常错位。比较发现NPMc突变体和NPM1野生样本之间有11个差异丰度的蛋白质;8个蛋白上调,其中,2个属于核导入蛋白家族的KPNA4和KPNB1(图4A)。在核导入蛋白家族中,NPMc突变的AML样本与健康的骨髓相比蛋白丰度更加明显(图4B)。在LFQ数据集中也有类似的(但没有统计学意义)趋势。在mRNA中没有看到类似的趋势(图4C)。
为了确定这种转录后调控的潜在机制,作者运用TurboID系统,用生物素对紧密相关的蛋白质进行近距离标记,在原代小鼠造血细胞中对NPMc的特异性物理相互作用进行了筛选。该系统显示与野生NPM1 TurboID融合相比,核导入蛋白KPNA3和KPNA4是NPMc的前30个生物素化蛋白之一,表明与突变体NPMc的物理接近(图4D)。研究核导入蛋白,发现突变体NPMc TurboID构建体与KPNA1、KPNA3、KPNA4、KPNA6和KPNB1的相互作用根野生NPM1 TurboID载体相比明显增加(图4E)。在这种短暂的过度表达后,这些蛋白质的总丰度变化很小(图4F),表明标签的增加是由于物理接近,而不是蛋白质丰度的增加。

图4 | 有NPMc突变的AML样本与几种核导入蛋白的丰度增加有关,NPMc与几个家族成员直接互动
5. CD180和MRC1/CD206在AML细胞上表达,而不是正常的CD34细胞
因为细胞表面的AML特异性蛋白可以作为免疫疗法的目标(例如,抗体-药物结合物、双特异性T细胞结合剂和/或嵌合抗原受体T细胞),于是在蛋白质组数据库中对相关蛋白进行了检索,将CD180和MRC1/CD206作为候选蛋白。
CD180是一个主要在B细胞上表达的Toll样受体,参与激活信号的传递;它已被确定为治疗B细胞非霍奇金淋巴瘤的候选靶标。发现CD180在许多AML样本中高度表达,但在健康的CD34+富集的干细胞或健康骨髓中却没有表达(图5A)。相应的RNA测序显示,CD180主要在一些AML样本和CD19+B细胞中表达,在较小程度上在单核细胞/巨噬细胞中表达(图5B)。同样,人类蛋白图谱单细胞转录组学数据库显示,该蛋白主要在B细胞和巨噬细胞/单核细胞中表达,在其他地方表达极少。此外,选定的患者样本和健康骨髓的流式细胞仪证实了CD180在AML细胞和CD19+B细胞上的表达,而在健康的CD34+干/祖细胞上没有检测到表达(图5C-E)。
MRC1/CD206是一种甘露糖受体,主要表达在M2免疫抑制性巨噬细胞47和肿瘤相关巨噬细胞(TAMs)的表面,这些巨噬细胞被认为会促进免疫抑制和促肿瘤的微环境。作者发现MRC1/CD206蛋白在AML样本的一个亚群中高度表达,但在CD34+健康骨髓细胞中没有表达(图5F)。RNA的表达证实了在许多AML样本中的高水平表达,在单核细胞中的表达较低,而在健康的CD34+细胞中的表达极少甚至没有(图5G)。
人类蛋白质图谱单细胞转录组学数据库显示,该基因主要在巨噬细胞和肝星形细胞上表达。部分患者样本的流式细胞仪证实MRC1/CD206确实在AML细胞和健康单核细胞上表达较高,但在健康CD34+细胞上没有表达(图5H-J)。综上所述,这些数据表明,CD180和MRC1/CD206可能是针对AML的候选药物,具有"靶向、非癌"等特征。


图5 | CD180和MRC1在一些患者的AML血浆中高度表达,但在CD34干/祖细胞中不表达
6. AML细胞的磷蛋白组学图谱
作者对44个AML样本和3个健康对照组中的磷酸化蛋白质组学进行了测定,总共检测到5407个蛋白质、29201个磷酸化位点。基于磷蛋白组图谱对患者进行无监督聚类,发现AML和健康对照组之间有明显的分离,同时发现了与激活的FLT3突变、PML-RARA融合(急性早幼粒细胞白血病[APL])和CBFB-MYH11融合相对应的群体(图6)。在对AML样本与健康对照样本的全面分析中,检测到4个关键位点(PTPN11酪氨酸-542,PRKCD酪氨酸-313,PRF4B酪氨酸-849,和PDHA1酪氨酸-242;(图7),还发现了STAT3信号增加与AML之间的联系,加强了PRKCD激活的证据,并表明在AML细胞中通过PTPN11进行了广泛的信号传导。
随后作者发现970个位点在AML样本和健康对照之间有明显的差异(图7C),其中包括致癌性丝氨酸/苏氨酸蛋白激酶AKT1上的2个激活位点(丝氨酸-124和丝氨酸-129)和DNMT3B上的多个位点(AML细胞中表达的2个新的甲基转移酶之一;另一个是DNMT3A,AML中最频繁突变的基因之一,图7D)。

图6 | AML样本的磷蛋白组学分析揭示了与一些起始事件和FLT3突变的关联
7. FLT3-TKD突变与SRC-家族酪氨酸激酶FGR和HCK的激活有关
随后作者观察到与受体酪氨酸激酶FLT3的激活性酪氨酸激酶域(TKD)突变有关的强烈的磷酸化信号(图6)。与FLT3正常样本相比,FLT3-TKD样本中有9个酪氨酸的磷酸化增加(图7E)。其中包括HCK的激活位点酪氨酸-411和FGR的酪氨酸-34,两者都是SRC家族的细胞质酪氨酸激酶(图7F)。
还确定了PRKCD的激活位点酪氨酸-313,酪氨酸蛋白磷酸酶PTPN6上的激活位点酪氨酸-5(它在Src信号的失活中起作用),ρ/Rac鸟嘌呤核苷酸交换因子VAV1上的高度保守的酪氨酸-844位点(在中性粒细胞激活中处于HCK和FGR的下游),以及G6PD上的酪氨酸-401位点(被SRC家族激酶磷酸化时增加活性)。最后,作者发现ATP1A1上的酪氨酸-260的磷酸化增加,它可以调节SRC家族激酶的活性。数据表明,SRC家族激酶HCK和FGR,以及下游激酶PRKCD在含有FLT3-TKD突变的AML细胞中被激活。在4个含有FLT3-ITD突变的显性亚克隆的样本中,这些磷酸位点表现出许多类似的趋势。
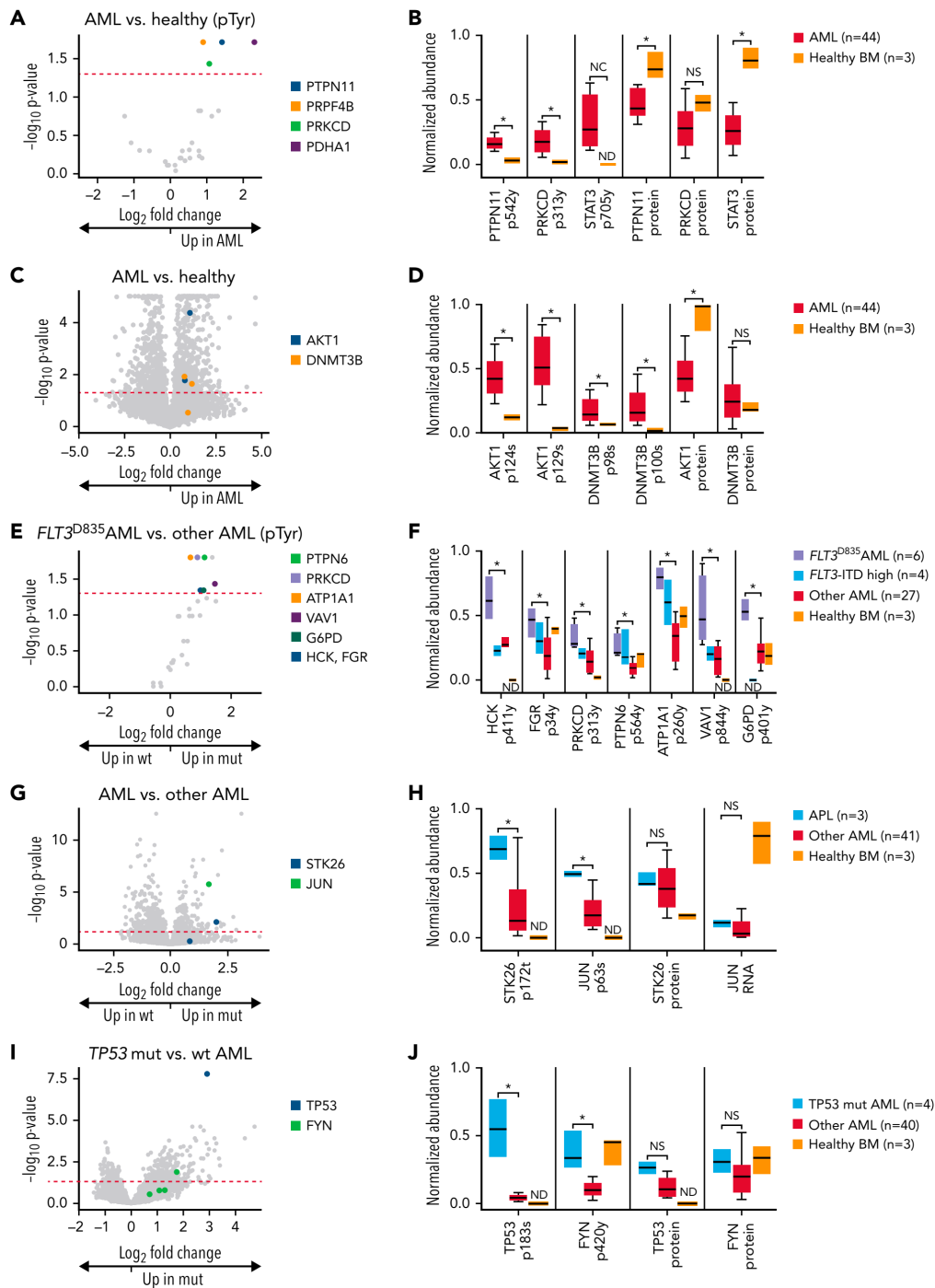
图7 | 与特定突变相关的AML样本的磷蛋白组学分析
8. 由PML-RARA启动的AML显示出一种磷蛋白组学特征
在由PML-RARA启动的APL样本中,作者确定了490个与其他AML样本明显不同的磷酸位点(图7G),其中包括丝氨酸/苏氨酸激酶STK26/MST4上的苏氨酸-172位点,以及致癌转录因子JUN上的关键激活位点丝氨酸-63;在APL样本中没有检测到STK26蛋白或JUN RNA(未检测到JUN总蛋白)的明显增加(图7H)。
9. TP53突变的AML显示大量的TP53磷酸化和激活的FYN
在TP53突变的AML样本中,有344个磷酸位点与其他AML明显不同(图7I),其中包括TP53本身的丝氨酸-183位点的磷酸化(标志着TP53的降解)和FYN酪氨酸激酶的激活位点酪氨酸-420;没有发现TP53或FYN蛋白水平的显著变化(图7J)
研究讨论
本研究从LAML TCGA数据集的44名有代表性急性髓系白血病(AML)患者和6个健康的骨髓来源对照组中开发了一个深度蛋白质组和磷酸化蛋白质组数据库。这个数据集的富含大量蛋白信息,包括识别转录后调节的蛋白质丰度,识别AML免疫学目标的细胞表面标志物,以及与AML发病机制相关的信号通路的磷酸化变化信息,为后续的急性髓系白血病研究提供参考。
小鹿推荐
本篇作者通过TMT标记定量蛋白质组学、4D-Lable free蛋白质组学等技术,为急性髓系白血病研究提供了一个深尺度的蛋白质组学和磷蛋白组学数据库,同时对AML发病机制和标志物筛选做了一系列分析,可作为进一步研究AML发病机制中蛋白质失调的基础。
DOI号:10.1182/blood.2022016033

长按扫码咨询鹿明生物4D蛋白质组学技术工程师
猜你还想看
1,项目文章 | 上海农科院食用菌研究所运用iTRAQ蛋白质组学探究草菇采后衰老机制
2,Nat Commun | 磷酸化+TMT蛋白质组学探究mTORC1调节溶酶体酸化和自噬机制,改善自噬信号异常疾病的治疗靶点
3,Theranostics | 医学一区,多组学研究表明他汀类药物可改善急性冠状动脉综合征患者的肠道微生物
4,微生物一区 | IF:30+,宏基因组+转录+代谢探究益生菌影响极早产儿肠道微生物组发育的重要驱动因素
END
叮当|撰文
Jack Chen|排版
欢迎转发到朋友圈
本文系鹿明生物原创
转载请注明本文转自鹿明生物

我知道你在看哟


点击“阅读原文”了解更多
-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章
-
微信文章

-
微信文章

-
微信文章

-
微信文章

-
微信文章
-
微信文章

-
微信文章








