单细胞测序中如何优雅地使用流式细胞分选技术

流式细胞术(flow cytometry)是20世纪60年代后期开始发展起来的一种基于荧光检测对细胞群的物理化学特征进行分析的技术。FACS(Fluorescence activated Cell Sorting)则是在流式细胞分析的基础上通过荧光激发实现对特定类型细胞进行分选的技术。随着单细胞测序技术的蓬勃发展,FACS在单细胞测序中也扮演了越来越重要的角色,为利用单细胞测序深入探究生物与医学中的科学问题提供了极大助力。
然而,流式细胞分选需要借助昂贵的流式细胞仪和一定的分选经验,对于刚刚接触此项技术的科研小伙伴来说,难免产生“只在此山中,云深不知处”的迷茫感。作为陪伴小伙伴们在科研路上一起跋涉的我们,也曾经历过类似的迷茫与困惑。因此,非常乐意与大家分享一些我们的实践经验,希望可以帮助大家早日“拨云见日,云开见月”!
一
流式分选如何选择喷嘴大小?
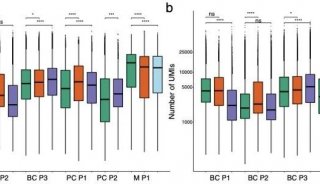
不同品牌的流式细胞分选仪在设计上各有特色,也都会配备不同大小的喷嘴。比较常见的是70μm、100μm和130μm三种规格。喷嘴越小分选速度越快,但鞘液压力也越高,对细胞活率的影响也越大。因此,应根据目标细胞的大小或细胞类型,选择合适大小的喷嘴。一般喷嘴大小应该是细胞大小的4-6倍,因此可以用流式进行分选的细胞大小一般不超过40μm。实际使用中,100μm大小基本可以满足外周血和大部分组织细胞的分选要求(见下图),但对于肝脏细胞、神经细胞等较大的细胞,应使用130μm的喷嘴。另外,当细胞类型比较特殊或者细胞处于比较脆弱的状态时,也建议采用大一号的喷嘴来降低鞘压对细胞活性的影响。

二
流式分选对细胞类型有要求吗?
从分选原理来看,只要细胞大小在合适范围内(<40μm)都可以通过流式细胞仪进行分选。然而,由于单细胞测序对于细胞活率要求比较高(>85%),而流式分选需要借助鞘压才能实现,会影响细胞活率,尤其是随着分选时间的延长,细胞活率可能会严重下降。因此,对于某些非常脆弱的细胞类型或非常稀有的细胞来说,通过流式分选富集到足够数量且质量符合上机要求的细胞,还是非常有挑战的。
三
流式分选对单细胞悬液质量有什么要求?
单细胞悬液的质量对于流式分选效果有直接的影响,悬液中目标细胞占比越高、结团和碎片越少、分选所需的时间越短,得到的细胞纯度和活率越高。因此,成功的流式分选有赖于高质量的单细胞悬液制备。当悬液中的结团或碎片较大或占比较高时,既容易造成仪器的管路堵塞,也增加了目标细胞正确圈门的难度。流式上机前,将悬液过40μm细胞筛去除较大的结团和碎片,可以有效防止管路堵塞的风险,但如果细胞悬液浓度过高或比较粘稠,在分选过程中也会造成悬液中细胞沉淀或结团的风险。对此,可以通过一些措施加以改善,比如:将细胞浓度调整到合适范围;对于易沉淀或结团的样本,分选时间较长时,间歇性地对样本管悬液进行振荡或吹打混匀等。另外,当解离的单细胞悬液中红细胞较多时,最好先用红细胞裂解液进行处理以控制细胞总数,缩短分选时间。
四
用于单细胞测序的流式分选技术,在
选择荧光抗体时应注意什么?
由于单细胞转录组测序是检测活细胞中的基因表达,因此,分选时一般是利用细胞膜表面蛋白的荧光抗体标记进行分选,而不用胞内蛋白。为减少实验操作及圈门时间过久对细胞的影响,应尽量采用特异性强的抗体对目标细胞进行直接分选。不同品牌的流式分选仪在荧光检测通道的数量和对应的荧光种类上有所区别,选择抗体的荧光标记或设计不同荧光抗体组合前,需要先了解所使用的流式细胞仪的品牌、型号以及不同通道可检测的荧光素,比如下图展示的是SONY SH800S流式细胞分选仪488/638两激光检测的荧光通道配置表。荧光标记的选择可遵循以下原则:①为获得较高活率的目标细胞,分选时一般使用DAPI、PI或7-AAD等荧光染料来区分死活细胞,选择抗体时应避开同通道的其他荧光标记;②多个荧光抗体组合使用时,一般用较强的荧光素(如PE)标记表达较弱的抗原,用较弱的荧光素(如FITC)标记表达较强的抗体,并且不同的抗体所偶联的荧光素应位于不同的检出通道。

五
流式分选如何设置对照?
流式细胞术作为一种免疫学实验检测方法,严格的对照设置是获得准确、可靠结果的前提。流式细胞术中的标准对照设置包括:生物学对照,空白对照,同型(Isotype control)对照,补偿对照,荧光减一(Fluorescence minus one,FMO)对照,其中,生物学对照、空白对照和补偿对照是流式分选目标细胞用于单细胞测序时经常要用到的。生物学对照即指实验设计中与处理组或表型组相对应的对照样本或野生型样本。空白对照就是将待分选的细胞悬液分出一部分,不加入任何荧光染料或荧光抗体进行流式分析,用来调节电压和设定各检测通道的阴性阈值,从而排除一些自发荧光的假阳性干扰。补偿对照又叫单阳性对照(单阳管),可以用细胞来做,也可以购买带有相应荧光标记的特殊微球。使用补偿微球作为补偿对照,既能节约时间和样本,又能避免因制备的细胞单阳管阳性信号弱而导致补偿效果不好的情况。因此,如果条件允许,最好使用补偿微球作为补偿对照。
六
流式分选时如何减少对细胞活率的影响?
在进行流式分选实验时,可以通过多个环节的的多种措施来减少分选对细胞活率的影响。
从仪器方面:根据品牌型号的不同,流式开机校准所需时间从半小时到1小时不等。为减少细胞等待时间,应尽量评估好细胞悬液制备完成的时间,提前完成流式仪的开机校准。如果分选仪的上样仓和收集仓的环境温度可以设定,则设定为较低的温度(5-10℃)。根据待分选的细胞大小和类型选择合适的喷嘴或芯片尺寸,并在鞘压和分选速度方面设定合适的参数值,避免压力过大或分选时间过长对细胞活率的影响。
从样本方面:在组织解离时通过裂红、过滤、清洗、去碎片等优化方法获得高质量的单细胞悬液后再分选。制备好的细胞悬液调整到合适的体积并始终保存在冰上备用。流式上机前将细胞过40μm细胞筛,避免管路堵塞等异常情况发生导致分选时间的延长。收集管中提前加入合适体积的收集液,以缓冲细胞落下时的冲击力。样本较多时,分批次解离以保证制备好的细胞悬液能够及时进行分选。分选时加入死活染料以去除死细胞的干扰。
以上就是我们整理的一些单细胞流式分选的实验经验,希望可以帮助到科研小伙伴们,也欢迎大家联系我们,和我们沟通交流!


上海欧易生物医学科技有限公司(简称:“欧易生物”),成立于2009年,经过十多年稳健发展,已经成长为拥有“晶准生物”“鹿明生物”“青岛欧易”三家全资子公司,近600名员工的生物科技领域集团型企业。
欧易生物始终秉持着“硬数据 · 好服务”的理念服务于大众。为大生命科学、大健康相关研究领域,以及医药、食品及日化企业的客户,提供从基础研究到药物靶点发现、药理药效及安全性评价、疾病分子标志物筛选、致病菌及耐药菌溯源等相关技术服务,全力加速客户研究与开发进程,提升客户研究与开发价值。

欧易生物携手旗下子公司,实现了中心法则上、中、下游多层组学的串联,从基因组、转录组、表观组、微生物组,到蛋白组、代谢组及近年热门的单细胞&空间多组学技术服务,为科研用户提供全面的创新多组学技术服务。

欧易生物已先后获得上海市科技小巨人企业、闵行区研发机构、闵行区企业技术中心、产权管理体系认证企业等资质。拥有授权发明专利30+项,在受理发明专利50+项,软件著作权150+项。


END
排版人:七七
原创声明:本文由欧易生物(OEBIOTECH)学术团队报道,本文著作权归文章作者所有。欢迎个人转发及分享,未经作者的允许禁止转载。