CELL METAB(IF:31.373) | 蛋白组学帮助研究运动带来全身代谢益处的机制

体育锻炼对慢性疾病有广泛的有益作用,其中包括2型糖尿病(T2D)、心血管疾病和代谢综合征等。然而,运动引起全身代谢益处的分子机制在很大程度上是未知的,这限制了开发干预措施的潜力。自噬是一种应激诱导的溶酶体降解途径,运动不仅激活收缩肌肉的自噬,还激活包括肝脏在内的非收缩组织的自噬。作者通过体外实验以及小鼠模型研究运动产生有益作用的机制。

2023年4月,美国西北大学在Cell Metabolism期刊发表的题为 “Exercise-activated hepatic autophagy via the FN1-α5β1 integrin pathway drives metabolic benefits of exercise”(IF:31.373)的研究成果,通过蛋白组学研究方法,发现了肝自噬激活是运动诱导的代谢益处所必需的,探究了FN1诱导自噬的机制。




研究材料:
(1) ATG7∆live小鼠模型
(2) WT小鼠
(3) 表达自噬体标记物的报告细胞
(4) FN1∆muscle小鼠模型
(5) ITGA5∆liver小鼠模型
研究技术:
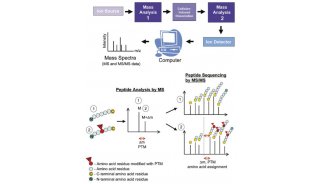
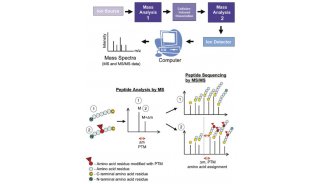
(1) 蛋白组学
(2) GTT(葡萄糖耐量测验)和ITT(胰岛素耐量测验)
(3) 纤维连接蛋白(FN1)ELISA
(4) 免疫组化(IHC)
(5) 定量PCR(qPCR)
(6) 免疫共沉淀
(7) 免疫印迹
1.肝自噬的激活对于运动诱导的代谢益处至关重要
作者通过AAV2/8(腺相关病毒2/8)建立了必需自噬基因ATG7的肝细胞特异性敲低(KD)模型(ATG7∆liver mice),如图1A。以注射空病毒AAV2/8-TBG-Null的小鼠为对照。免疫组化染色显示,自噬抑制在ATG7∆liver小鼠肝脏中是均匀的。
在常规饮食(RD)喂养下,实验组小鼠生理指标与对照组类似。但在同时进行高脂饮食(HFD)喂养和跑步机运动训练后,尽管两组体重(图1B)和运动耐力等相当,但实验组小鼠未能表现出运动诱导的葡萄糖耐量或胰岛素敏感性的改善(图1C)。此外,磷酸化分析发现,实验组小鼠的肝脏胰岛素信号传导在运动后没有像对照组那样增强(图1D)。以上数据表明,运动期间肝脏的自噬激活对于运动诱导的抗HFD代谢益处至关重要。

图1 肝自噬的激活对于运动诱导的抗高脂饮食至关重要
2 运动诱导促自噬FN1的分泌
使用报告细胞表达自噬体标记物GFP-LC3,发现当它被添加到培养基中时,运动WT小鼠的血浆,足以激活自噬通量(图2A)。此外,运动WT小鼠的血清也提高了自噬通量。这些数据表明,运动小鼠的血浆或血清可以自主激活非细胞自噬。补充过量的外源性胰岛素,锻炼过的小鼠血清仍然诱导报告细胞表达mCherry-GFP-LC3(图2B)。这表明运动诱导的系统性自噬不是由减少循环胰岛素水平所引起的。作者提出了有新的运动诱导循环因子介导了运动过程中的肝脏自噬激活。
对WT小鼠运动前后的血清进行了蛋白质组学分析,并确定了一个候选蛋白FN1(图2C)。ELISA研究也证实了WT小鼠运动后血浆FN1水平升高(图2E)。重要的是,这种循环FN1的增加是由运动引起的,而不是由禁食引起的(图2F)。使用AMPK激活剂AICAR模拟细胞培养系统中的运动条件,发现可诱导FN1分泌到培养基中,但仅在分化的肌细胞中,但不在肝细胞或未分化的成肌细胞中(图2G)。实验发现FN1在运动反应中,受到肌细胞的刺激分泌,并由AMPK激活触发。此外,纯化的FN1,在营养丰富的条件下诱导自噬通量(图2H)。总的来说,确定了一种运动诱导的循环因子FN1,它可以自主激活非细胞内的自噬。

图2 鉴定FN1是一种运动诱导的且肌肉分泌的自噬诱导的因子
3 由收缩的肌肉分泌的FN1介导运动诱导的肝自噬和全身胰岛素敏化
通过aav2/9介导的由肌肉特异性MHCK7启动子驱动的FN1 shRNA传递到WT或GFP-LC3报告小鼠中,产生肌肉特异性FN1消耗(FN1∆muscle)小鼠(图3A)。在实验小鼠中,肌肉特异性的FN1消耗几乎完全消除了运动引起的循环FN1的急性增加(图3B)。重要的是,肌肉特异性FN1的消耗不会影响运动诱导的肌肉自噬(图3C)和最大运动能力(图3D)等,但会阻止肝脏中运动诱导的自噬(图3E)。这表明肌肉分泌的FN1是运动过程中肌肉-肝脏交流和肝脏自噬激活所必需的。
在RD喂养下,实验组和对照组小鼠的体重、GTT(葡萄糖耐量测验)和ITT(胰岛素耐量测验)指标相似。但是,在同时进行HFD喂养和运动训练后,仅改善了对照组小鼠的GTT和ITT值,而实验组的小鼠则没有得到改善(图3G)。此外,对照小鼠在肌肉和肝脏中表现出运动诱导的胰岛素信号改善,但实验组小鼠仅在肌肉中表现出胰岛素信号的改善,而不是在肝脏中(图3H)。综上,运动诱导的肌肉分泌FN1上调了非收缩性肝脏的自噬活性和胰岛素敏感性。

图3 肌肉分泌的FN1介导运动诱导的肝自噬和胰岛素致敏
4 肌肉分泌的FN1通过α5β1整合素-ikka/b-JNK1通路激活肝自噬
α5β1整合素被认为是FN1的受体。整合素的α5(ITGA5)或β1(ITGB1)亚基的KD均能消除报告细胞中运动小鼠血清激活的自噬通量(图4A),这表明α5β1整合素是运动诱导的自噬所必需的。相比之下,α5β1整合素的KD不影响基础或禁食诱导的自噬通量(图4B)。此外,IκB激酶(IKK)复合物,被确定为整合素下游的关键信号分子,并参与禁食和细胞脱离诱导的自噬。由于IKK的激活进一步导致JNK1/2的磷酸化,而IKK诱导自噬的能力是JNK依赖的。事实上,研究者发现来自运动小鼠的血清激活了自噬报告细胞中的IKK和JNK,以及典型的FN1整合素信号分子,如Src和FAK的磷酸化(图4C),这些细胞依赖于ITGA5和ITGB1(图4D),说明运动诱导的血清确实刺激了α5β1整合素介导的细胞信号。此外,纯化FN1处理和双敲低IKKα和IKKβ实验支持了FN1介导的JNK激活是通过肝细胞中的IKKa/b实现的的结论。在体内,运动激活了对照组小鼠肝脏中的IKK、JNK、Src和FAK,但在FN1∆muscle小鼠中却没有激活(图4E)。
体外禁食或神经酰胺治疗条件,JNK1通过磷酸化BCL2位点调节必需自噬蛋白BECN1与其抑制剂BCL2之间的可逆结合。通过共免疫沉淀,作者发现运动诱导BCL2在70位的磷酸化,并降低对照小鼠肝脏中BECN1-BCL2的结合,但在FN1∆muscle小鼠的肝脏中显著减少(图4H)。综上所述,作者认为肌肉分泌的FN1通过激活α5β1整合素-IKK-JNK1通路上调自噬。

图4 肌肉分泌的FN1通过α5β1整合素-IKKa/b-JNK1-BECN1途径激活肝自噬
5 肝脏α5整合素对于运动诱导的IKK-JNK1-BECN1激活、肝脏自噬和全身代谢益处至关重要
作者建立了肝脏特异性缺乏α5整合素亚基的小鼠(ITGA5∆liver)模型(图5A)。与对照小鼠类似,ITGA5∆liver小鼠和ATG7∆liver小鼠均有正常的运动诱导循环FN1水平(图5B)。然而,ITGA5∆liver小鼠运动后肝脏中IKK、JNK、Src和FAK激活和BECN1- bcl2解离存在缺陷,这表明它在上游发挥作用,介导其在肝脏中的激活,而ATG7作用于IKKJNK-BECN1通路的下游或平行。肝脏中ITGA5或ATG7的缺失显著逆转了运动诱导的自噬底物SQSTM1/p62水平的降低(图5C),证实了它们在运动诱导的肝脏自噬中都起作用。
ITGA5∆liver小鼠在肝脏中表现出运动诱导的自噬缺陷,而不是禁食诱导的自噬缺陷(图5E),这与体外结果一致。在不运动的时,不同喂养方式的实验组和对照组小鼠的生理数据相似,但是再加上日常运动后,只在对照组小鼠中改善了糖耐量、胰岛素耐量和肝脏胰岛素信号(图5G和H)。这些数据表明,肝脏α5β1整合素在调节运动诱导的胰岛素致敏作用中起着重要作用。

图5 肝脏α5整合素对运动诱导的IKK-JNK1-BECN1激活、肝脏自噬和全身代谢益处至关重要

总的来说,该文章表明肝脏自噬激活对于运动诱导的代谢益处至关重要。使用运动小鼠的血浆或血清足以激活细胞中的自噬。通过蛋白质组学研究,将FN1鉴定为潜在的目标蛋白。肌肉分泌的FN1通过肝受体α5β1整合素和下游IKKα / β-JNK1-BECN1途径介导运动诱导的肝自噬和全身胰岛素敏化。

文章推荐
通过蛋白质组学研究,作者将纤连蛋白(FN1)鉴定为运动诱导的、肌肉分泌的、自噬诱导的循环因子,再结合体外和动物实验研究其FN1通过肝脏α5β1整合素途径诱导自噬和系统代谢益处。
参考文献:doi.org/10.1016/j.cmet.2023.01.011
.
文末看点|lumingbio
上海鹿明生物科技有限公司是欧易生物旗下从事蛋白质组及代谢组质谱检测的专业质谱组学服务公司。公司建有国内第一个空间代谢组商业服务平台,深耕质谱组学检测分析,具体包括空间代谢组、双平台代谢组、靶向代谢组、TMT标记定量蛋白组、翻译后修饰蛋白组、4D-DIA蛋白组、单细胞及超微量蛋白组、空间蛋白组等。创新质谱组学平台广泛应用于机制解析、分型诊断、标志物筛选、药靶发掘等多个领域。公司并先后获得高新技术企业、上海市专精特新企业并建有院士专家工作站,自有包括tims tof pro2在内的各类大型质谱近二十台套,年服务项目超2000项。鹿明生物协助合作伙伴发表SCI论文近千篇,成功打造以硬数据、好服务为基础,以空间代谢组为特色的质谱组学检测服务公司品牌。

精彩往期推荐
BAM(IF=16.874)| 外泌体蛋白质组探究壳聚糖寡糖促进外周轴突再生机制
2023-06-01
2023-05-26
外泌体蛋白质组|蛋白质组学研究助力阿尔兹海默症生物标志物筛选
2023-05-18
2023-05-11
END
Lemon 撰文
欢迎转发到朋友圈
本文系鹿明生物原创解读
转载请注明本文转自鹿明生物

我知道你在看哟

![]()
点“阅读原文”了解更多