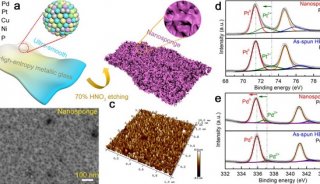
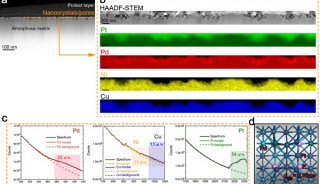
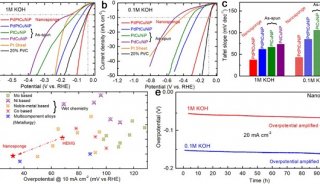
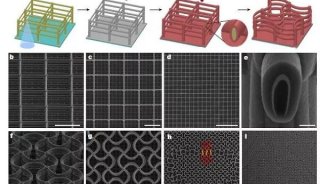
电化学
电化学是研究两类导体形成的带电界面现象及其上所发生的变化的科学。如今已形成了合成电化学、量子电化学、半导体电化学、有机导体电化学、光谱电化学、生物电化学等多个分支。电化学在化工、冶金、机械、电子、航空、航天、轻工、仪表、医学、材料、能源、金属腐蚀与防护、环境科学等科技领域获得了广泛的应用。当前世界上十分关注的研究课题,如能源、材料、环境保护、生命科学等等都与电化学以各种各样的方式关联在一起。
电化学(Electrochemistry),一是电解质的研究,物质结构。
原电池
原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.又称非蓄电池,是电化电池的一种,其电化反应不能逆转,即是只能将化学能转换为电能,简单说就即是不能重新储存电力,与蓄电池相对。
原电池是将化学能转变成电能的装置。所以,根据定义,普通的干电池、燃料电池都可以称为原电池。
组成原电池的基本条件:
1、将两种活泼性不同的金属(即一种是活泼金属一种是不活泼金属),或着一种金属与石墨(Pt和石墨为惰性电极,即本身不会得失电子)等惰性电极插入电解质溶液中。
2、用导线连接后插入电解质溶液中,形成闭合回路。
3、要发生自发的氧化还原反应。
原电池工作原理
原电池是将一个能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。
原电池的电极的判断:
负极:电子流出的一极;发生氧化反应的一极;活泼性较强金属的一极。
正极:电子流入的一极;发生还原反应的一极;相对不活泼的金属或其它导体的一极。
在原电池中,外电路为电子导电,电解质溶液中为离子导电。
原电池的判定:
(1)先分析有无外接电路,有外接电源的为电解池,无外接电源的可能为原电池;然后依据原电池的形成条件分析判断,主要是“四看”:看电极——两极为导体且存在活泼性差异(燃料电池的电极一般为惰性电极);看溶液——两极插入溶液中;看回路——形成闭合回路或两极直接接触;看本质——有无氧化还原反应。
(2)多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看做电解池。
电解池
电解池是将电能转化为化学能的装置。
电解是使电流通过电解质溶液(或熔融的电解质)而在阴、阳两极引起氧化还原反应的过程。电解是使电流通过电解质溶液(或熔融的电解质)
发生电解反应的条件:
①连接直流电源
②阴阳电极阴极:与电源负极相连为阴极
阳极:与电源正极相连为阳极
③两极处于电解质溶液或熔融电解质中
④两电极形成闭合回路
电解过程中的能量转化(装置特点):
阴极:一定不参与反应不一定惰性电极
阳极:不一定参与反应也不一定是惰性电极
电解结果:
在两极上有新物质生成
电解池电极反应方程式的书写:阳极:活泼金属—电极失电子(Au,Pt除外);惰性电极—溶液中阴离子失电子
注:失电子能力:活泼金属(除PtAu)>S2->I->Br->Cl->OH->含氧酸根(NO3->SO42-)>F-
阴极:溶液中阳离子得电子
注:得电子能力:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H2O(水)>Al3+>Mg2+>Na+>Ca2+>K+(即活泼型金属顺序表的逆向)
对应关系:阳极连电源正极,阴极连电源负极(可见高中教材*《化学选修·四》)
规律:铝前(含铝)离子不放电,氢(酸)后离子先放电,氢(酸)前铝后的离子看条件。
四类电解型的电解规律①电解水型(强碱,含氧酸,活泼金属的含氧酸盐),pH由溶液的酸碱性决定,溶液呈碱性则pH增大,溶液呈酸性则pH减小,溶液呈中性则pH不变。电解质溶液复原—加适量水。
②电解电解质型(无氧酸,不活泼金属的无氧酸盐,),无氧酸pH变大,不活泼金属的无氧酸盐PH不变。电解质溶液复原—加适量电解质。
③放氢生碱型(活泼金属的无氧酸盐),pH变大。电解质溶液复原—加阴离子相同的酸。
④放氧生酸型(不活泼金属的含氧酸盐),pH变小。电解质溶液复原—加阳离子相同的碱或氧化物。
-
项目成果
-
项目成果

-
科技前沿

-
科技前沿
-
科技前沿

-
焦点事件

-
焦点事件