实验室分析方法--离子交换色谱法原理及发展
离子交换色谱( ion exchange chromatography,IEC)是最早应用的液相色谱技术之离子交换色谱法针对离子型样品,根据样品离子与固定相表面离子交换基团的交换能力差异进行分离,对生物样品,如蛋自质、肽类、氨基酸、核酸、核苷、碱基、碳水化合物等的分离尤为适宜,因此已成为相关领域中非常有效的分析检测和分离纯化手段。
一、原理与色谱柱推荐
IEC分离机理建立在样品分子与固定相表面基团之间电荷相互作用的基础上,这种相互作用可能表现为离子与离子、偶极与离子或者其他动态平衡作用力的形式。图1直观地给出了样品离子在色谱柱中发生的离子交换过程。样品离子将同离子从固定相表面顶替下来带电性质、分子结构等不同,其与固定相表面的作用力也不同,因此被顶替的难易程度存在差异,最终实现分离。
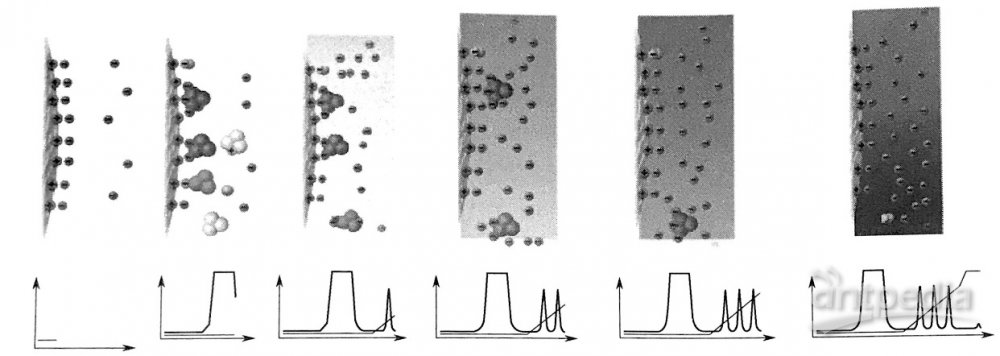
图1 溶质离子在IEC色谱柱中发生的离子交换过程
按所使用的离子交换剂的不同,IEC方法可分强阴、强阳、弱阴、弱阳离子交换色谱四种模式。离子交换固定相大多在有机高聚物或硅胶上接枝离子交换基团制备。离子交换剂上的活性离子交换基团决定着其性质和功能,带磺酸基的为强阳离子交换剂;带羧酸基的为弱阳离子交换剂:带季铵基(一RN)的为强阴离子交换剂;带伯、仲、叔氨基的为弱阴离子交换剂。使用最多的阴离子交换基团是季铵、二乙氨基乙基和聚乙亚胺,使用最多的阳离子交換基团是磺丙基和羧基。
硅胶基质离子交换键合相具有刚性强、耐压及无树脂固有的溶胀和收缩现象等优点。此外,硅胶基质粒度小、均匀性好、表面传质过程快,因而柱效比离子交换树脂柱高。离子交换键合相柱的操作比树脂柱简单,通常在室温下操作即可获得良好的分离。
有机高分子类离子交换固定相如纤维素、葡萄糖、琼脂糖的衍生物等具有全pH值(1范围适用、可以选择各种缓冲液流动相体系、使用寿命长、色谱柱易于再生、固定相色谱容量高、非特性吸附少、有利于保持样品生物活性等特点,因此在离子交换色谱固定相中占据主要地位。
聚合物基质的离子交换色谱固定相通常用聚苯乙烯和二乙烯基苯进行交联共聚生成不溶性的聚合物基质,再对芳环进行磺化制成强酸性阳离子交换剂;或对芳环进行季铵盐化,制成带有烷基胺官能团的强碱性阴离子交换剂。虽然多孔聚苯乙烯树脂仍在HPLC中使用,但其柱效较低,这是由于聚合物基质中的微孔扩散速度较慢,导致传质阻力较大造成的。常用的聚合物基质还有PS-DVB、羟基化聚醚凝胶、交联聚甲基丙烯酸羟基乙酯等。
两性离子交换剂是一类具有特殊结枃的离子交换剂,在其基质中既含有阳离子交换基团,又含有阴离子交换基团。这类离子交换剂在与电解质接触时可形成内盐,用水洗的办法很容易使其再生。偶极子型离子交换剂作为两性离子交换剂的一种特殊类型,通过氨基酸键合到葡聚糖或琼脂糖上制得,其在水溶液中可形成偶极子,这种离子交换剂非常适合于能与偶极子发生相互作用的生物大分子的分离。
以多糖类软质凝胶(包括葡聚糖、琼脂糖、纤维素等类型)作为基质的离子交换固定相具有全pH值(1~14)范围适用、与各种缓冲液流动相体系兼容、非特性吸附少、有利于保持样品生物活性、良好的亲水性和生物相容性、使用寿命长、色谱柱易于再生、样品负载量高、价格便宜等特点。虽然也有机械强度较低、只能在低流速下使用的缺点,但其仍在离子交换色谱固定相中占据主要地位。
非多孔结构可以有效地避免溶质在固定相内部的吸附与扩散,所以对改善色谱柱效、提高样品回收率以及保持大分子溶质的生物活性都是很有利的,但交换容量相对较低。这类填料普遍有很高的柱效和样品回收率,尤其适合于快速分离活性生物大分子。用作高效分离柱的非多孔型填料,一般粒度只有几微米,颗粒小而均匀,刚性良好,色谱穿透性强,流速适应范围宽。
二、流动相
离子交换色谱常用缓冲溶液作为流动相,有时加入与水混溶的有机溶剂。水不仅是理想的溶剂,同时还具有使溶质离子化的特性。被分离组分在离子交换柱中的保留时间除与样品组分的离子和树脂上的离子交换基团作用的强弱有关外,还受流动相的pH、离子强度、加入有机溶剂种类等因素的影响。
改变流动相的pH值还会影响弱酸性或弱碱性溶质的电离情况,从而改变其对溶质保留的强弱。强阳/阴离子交换剂的交换容量(单位质量交换剂中有用官能团数目)不随pH值改变。但改变pH值可以增加或减少弱离子交剂离子交换基团上可解离的H+或OH-的数目,因此流动相pH值直接影响固定相的离子交换容量图2为不同模式离子交换树脂的交换容量随pH值的变化关系。

图2 离子交换树脂的交换容量
pH值降低,弱阳离子交换剂的离子化受到抑制,交换容量降低,溶质的保留值减小;阴离子交换剂则恰好相反。当pH值增大,酸失去质子,发生解离,产生在阴离子交換固定相上保留的离子;反之,当pH值减小,碱得到质子,产生在阳离子交换固定相上保留的正离子。因此,ph值增大时,在阴离子交换色谱中组分的保留值增大,在阳离子交换色谱中组分的保留值将减小。流动相pH值的变化也能改变分离的选择性,不过选择性随pH值的变化较难预测。使用阳离子交换剂时,常选用含磷酸根离子、甲酸根离子、醋酸根离子或柠檬酸根离子的缓冲液;使用阴离子交换剂时,则常选用含氨水、呲等的缓冲液。
离子交换色谱中的溶剂强度主要取决于流动相中盐的总浓度即离子强度,增加流动相中盐的浓度,溶质离子与所加盐的离子争夺离子交换基团上反电荷位置的能力降低,溶质的保留值降低。流动相的离子强度越高,越不利于溶质的解离,也降低了溶质的保留。由于不同盐的离子与离子交换剂作用强度不同,因此流动相中所加盐的类型对样品离子的保留值有很大影响。在阴离子交换色谱中,具有不同阴离子的盐相对洗脱强度顺序为:
F—(弱)<OH —<CH3COO— <CI—<SCN— <Br—< CrO4—.<NO3— <I—<C2O4— < SO22—
<柠檬酸根(强)
在阳离子交换色谱中,阳离子的洗脱强度顺序为:
Li+(弱)<H+<Na+<NH4+<K+<Rb+<Cs+<Ag+<Mg2+<Zn2+<Co2+<Cu2+<Cd2+<Ni+<Ca2+<Pb2+<Ba2+(强)
在离子交换流动相中加入少量的甲醇、四氢呋喃、乙腈等有机溶剂,可以增加样品的溶解度,减少峰拖尾现象,但是有机溶剂的加入也会导致保留值下降。
三、方法发展
建立离子交换分离方法选用的色谱柱必须与待分离组分相匹配。例如,对酸性化合物或阴离子,采强阴离子交换柱;对碱性化合物或阳离子,采用强阳离子交换柱。通常不用离子交换法同时分离阳离子和阴离子。
阴离子交换分离要求流动相的pH值大于样品的pKa,通常采用pH>6的水缓冲液作为流动相;而阳离子交换则要求pH<pKa,通常采用pH<6的水缓冲液。初始条件的流动相中缓冲盐浓度应较低(2~5 mmol/L),以避免与样品离子竞争保留。
通常需在水缓冲液中加入0.5~1molL的盐以保持一定的离子强度。采用NaCl可实现在低波长下的检测,但是pH值较低(pH<5)时,容易腐蚀系统管路,需每天冲洗系统。乙酸钠对系统无腐蚀性,但只能在230mm以上检测。硫酸钠和磷酸钠也无腐蚀性,其中磷酸钠洗脱能力较强,可在低浓度下进行洗脱。
在流动相中加入有机溶剂可避免样品聚集或疏水作用引起的峰展宽或变形。高浓度有机溶剂可能会破坏生物样品活性,如无需考虑失活,则可加入较高浓度有机溶剂以改善峰形。
与反相分离类似,用0~100%盐梯度确定样品的相对保留值,判断等度分离可行性及等度分离的盐浓度。如溶质在初始条件下不能全部流出色谱柱,则可通过增加柱温、流动相中加入一定比例的甲醇改善分离,也可改用弱阴/阳离子交换柱降低溶质的保留值对离子交换分离方法进行优化可采用多种途径,如改变梯度程序、缓冲溶液pH、流动相中盐的种类和浓度、有机调节剂种类和加入量等。




















