实验室分析方法--反向液相色谱法原理及发展
反相液相色谱(RPLC)是分离大多数常规样品的首选分离模式,它比其他液相色谱分离模式的适用范围更宽、更方便。据统计,在高效液相色谱法中,70%~80%的样品可采用反相键合相色谱法完成。极性、非极性,水溶性、油溶性,离子性、非离子性,小分子、大分子,以及具有官能团差别或分子量差别的同系物,均可采用反相液相色谱技术实现分离。
一、原理及色谱柱推荐
反相色谱固定相的极性弱于流动相,样品在极性流动相和非极性固定相间分配,疏水性强(非极性)的化合物保留较强,流动相组成一定时,样品按照其疏水性由弱到强的顺序流出色谱柱。
用于反相色谱分离的固定相一般通过在基质(包括高纯硅胶、有机聚合物、石墨化碳及有机-无机杂化材料等)表面共价键合有机硅烷或沉积聚合物有机涂层,其中应用最为广泛的是硅胶基质的化学键合相固定相,也可对多孔聚合物微粒加以改性得到不同选择性的反相谱固定相,如修饰了
C18烷基侧链的聚丙烯酰胺、聚甲基丙烯酸的烷基酯化物、聚乙烯醇的酯化物、C18烷基键合的聚乙烯醇、C18烷基衍生的交联聚苯乙烯以及苯基或烷基衍生的羟基化聚醚树脂等。
化学键合反相色谱中,随着键合相疏水基团链长的增加或疏水性的增加而增大。键合烷基的链长对键合相的样品负荷量、溶质的容量因子及其选择性有不同的影响,当烷基键合相表面浓度(mol/m2)相同时,随着烷基链长增加,溶质的保留值增加。烃基链长可以是C2、C4、C6、C8、C16、C18、C22、C30等,图1为ODS(C18)的空间结构示意图。ODS有较高的碳含量和好的疏水性,对各种类型的样品分子有较强的适应能力,从非极性的芳烃到氨基酸、肽、儿茶酚胺和许多药物的分析皆可适用。
从图1可见,疏水性烷基链几乎全部覆盖在基质硅球的表面。一般认为,反相色谱普的分离机理为液液分配过程。但也有人证实,对不同的样品,采用ODS色谱柱进行分离,可能同时存在吸附和分配两种机制,且随样品结构及流动相组成的变化而变化。图2描述了溶质在ODS表面的行为。弱溶剂水不与疏水性的C18链产生强的相互作用,强溶剂可以将溶质从固定相上顶替下来。
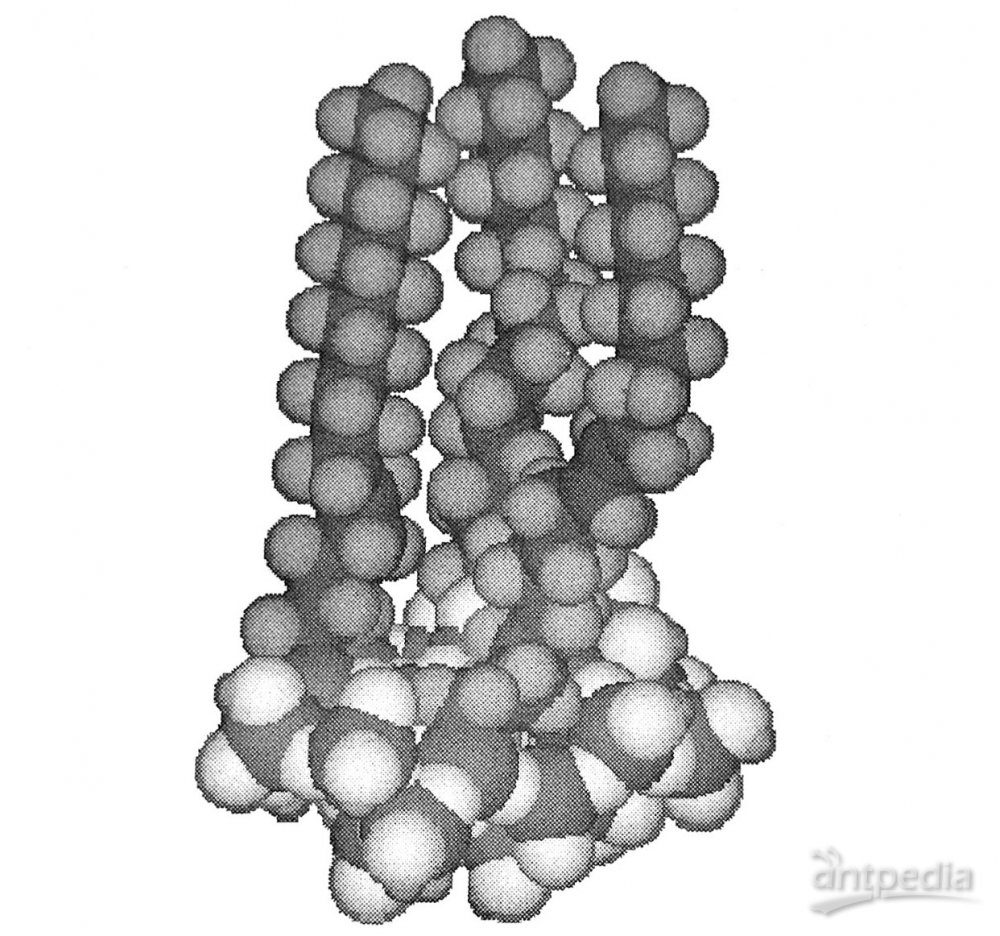
图1 ODS空间结构示意图
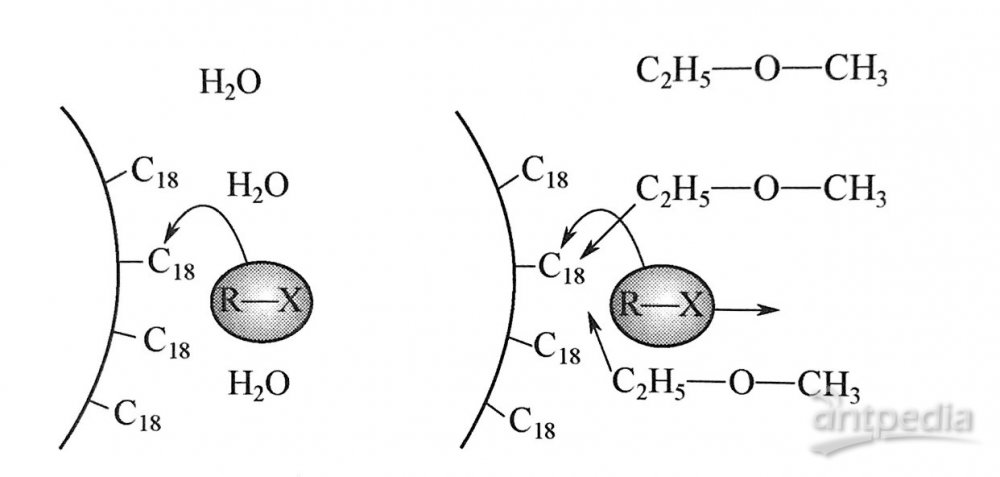
图2 溶质在ODS表面的行为
多环芳烃键合相与C18性质接近,适合于芳香族化合物的分离。键合短链烷基(C3、C4)的大孔硅胶(20~40nm)键和含氟硅烷键合相的发展满足了蛋白质、酶等生物大分子分离的需要。由于碳氟键的极性比碳氢键更强,氟的引入使卤代化合物或其他极性化合物在固定相上保留更强,分离选择性也会发生变化。全氟烷基键合固定相可以应用于表面活性剂分析、超临界流体色谱、离子对分离等方面。不经过特殊衍生处理的石墨化碳固定相作为反相色谱固定相,除了可以在低或高pH值条件下运行外,还可同时实现高温快速分离。
短链烷基(C6、C8)硅烷由于分子尺寸较小,与硅胶表面键合时可以有比长链烷基更高的覆盖度和较少的残余羟基,适合于极性样品的分析。为适应蛋白质、酶等生物大分子分离的需要,一些键合有短链烷基(C3、C4)的大孔硅胶(20~40nm)键合相也发展起来。与C18相比,C4、C8等的疏水性较弱,因此对于溶质的保留随碳链的加长而逐渐增强,见图3。
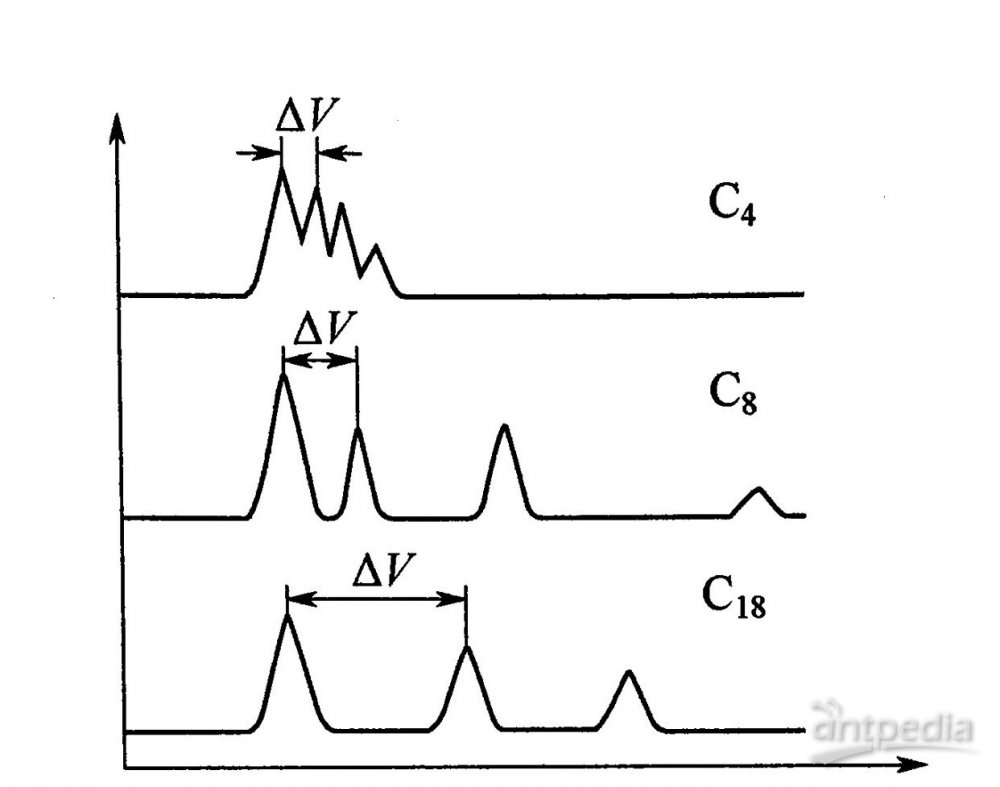
图3 溶质保留值随固定相修饰碳链接长度的变化
硅胶键合固定相对碱性化合物的吸附主要是表面残余硅羟基和微量不纯金属杂质的作用,采用金属杂质含量极低的硅胶作为制备键合固定相的基质能够部分改善固定相性能。在色谱分离中,可通过在流动相中添加胺改性剂、降低流动相pH值、增加流动相离子强度、加入离子对试剂等方法消除残余硅羟基的作用。此外,在pH>8的流动相条件下,SiO2会溶解,而在pH<2时,键合相会逐渐水解,因此硅胶基质固定相能够稳定使用的pH值范围相对较窄,不能满足部分样品尤其是生物组分和碱性药物的分离要求。
采用高分子反相固定相时,可根据被分离样品的分子量大小选择合适孔径的固定相。PLRP-S固定相分离肽类和蛋白质时,孔径为10nm的固定相,适合于分离15~20个氨基酸长度的肽类;孔径为30nm的固定相,适合于中等分子量的球形蛋白质;孔径为100nm的固定相,适宜于较大的球状蛋白质或纤维状结构的化合物;而孔径为400nm的超大孔固定相,则可分离很大分子量的样品。 RPLC中常用的固定相见表1。
表1 RPLC中常用的固定相
固定相 | 特点 |
化学键合相 | |
C18(十八烷基或ODS) | 稳定性好;保留能力强;用途广 |
C8(辛基) | 与C18相似,但保留能力降低 |
C3,C4 | 保留能力弱;多用于肽类与蛋白质分离 |
C1[三甲基硅烷(TMS)] | 保留最弱;最不稳定 |
苯基,苯乙基 | 保留适中;选择性有所不同 |
—CN(氰基) | 保留值适中;正相与反相均可使用 |
—NH2(氨基) | 保留弱;用于烃类;稳定性不够理想 |
全氟代烷基 | 对卤代化合物,芳香异构体和其他极性化合物的保留更强 |
非化学键相和 | 1<pH<13,流动相中稳定;对某些分离峰形好,柱寿命长 |
聚苯乙烯基石墨化碳 | 0<pH<14,流动相中稳定;可在高温下使用 |
二、流动相
在反相色谱中,流动相的极性大于固定相极性,溶质按其疏水性大小进行分离,极性越大或疏水性越小的溶质,与非极性的固定相的结合越弱,越先被洗脱。
反相色谱中改变分离选择性的方法包括:流动相组成、柱类型和柱温。通过改变流动相组成可以便捷有效地改善分离选择性。反相色谱流动相通常以水为基础,加入一定量的能与水互溶的甲醇(MeOH)、乙腈(ACN)、四氢喃(THF)等极性溶剂。选择不同的有机溶剂不仅影响溶质的保留,对分离选择性也有影响。
甲醇毒性为乙腈的1/6,价格便宜,是反相色谱中使用最多的非极性溶剂。其给予质子和接受质子的能力最强,氢键作用力最大。与甲醇相比,乙腈的溶剂强度较高且黏度低,且可满足在紫外区185~205nm检测的要求。四氢呋喃分子体积较大,色散力、疏水作用最强,洗脱强度最大。
流动相的强度随着溶剂的极性增加而降低。常用溶剂洗脱强度的强弱顺序为:
水(最弱)<甲醇<乙腈く乙醇く四氢呋喃<丙醇<二氯甲烷(最强)
对于强疏水性样品,采用100%乙腈仍无法洗脱时,可考虑采用更强的流动相(如高百分比的THF—H2O体系或THF—ACN体系)。除二氯甲烷与水无法混溶外,上述其他浓、与水混用。二氯甲烷常用来清洗被强保留样品污染的反相色谱柱。甲醇、乙晴和四水的混合物的洗脱强度之间存在以下经验换算关系:
θ乙腈=0.32θ2甲醇+0.57θ甲醇
θ四氢呋喃=0.66θ甲醇
其中,θ甲醇、θ乙腈 、θ四氢呋喃分别为乙腈、甲醇和四氢呋喃与水混合溶剂的体积分数。上,除了考虑洗脱强度外,还必须考虑分离选择性的变化。
流动相中不含水的分离模式称为非水反相色谱(NARP),主要用于保留极强或即使采100%乙腈仍难以洗脱的强疏水性样品的分离。NARP流动相通常为极性不同的两种有染的混合液。一般来说,高极性的溶剂采用乙腈或甲醇,低极性溶剂采用四氢呋喃、氯仿、氯甲烷、丙酮等。通过改变两种有机溶剂的比例或温度可有效控制样品的保留强弱。由于用二氯甲烷等溶剂限制了低波长UV检测的应用,且正相色谱能够方便地分离强极性样品通常情况下不推荐采用NARP。
三、方法发展
在建立反相液相色谱方法时,初始实验通常采用普适性较好的C8或C18柱。色谱柱应具有适当的反压(<2500pSi)、合理的柱效(N>8000)、运行时间短(<15min)。通常采用046cm×15cmX5μmC18或C8柱。进样前用10倍柱体积流动相平衡以保证实验的重现性为获得较低的柱压和较高的柱效,初始柱温可设定为35℃或40℃,没有柱温箱的情况下则在室温下测定。为保证检测灵敏度,初始进样量可设为25~50μl,方法优化后根据柱尺寸减小至所需值(如采用
θ内0.4~0.5cm色谱柱时,进样量应小于25μl或10μg)
采用反相液相色谱法可通过改变流动相种溶剂种类、浓度(B%)和柱温等参数实现多数样品的分离。初始流动相pH通常选取较低pH值(pH=2~3),这是因为在低pH下,硅羟基质子化从而可以降低其活性。此外,由于与常见酸碱官能团pKa相差较远,具有酸碱性样品的保留不会受到pH值微小变化的影响。方法优化过程中如需对pH进行优化,应在其他条件优化后进行。
综上所述,对于中性样品,初始条件为15cm×5μmC18或C8柱,乙腈-水流动相,2 ml/min流速,柱温35℃或40℃,梯度设置采用5%~100%乙腈,6min;对于离子型样品,流动相水相改为25~50mol/L磷酸缓冲溶液(pH=2~3);对于中性和离子型共存的样品,采用后者作为流动相。
根据初始条件获得的色谱图可以初步判断所需要发展的方法采用等度洗脱或梯度洗脱。如果所有组分均在相对较窄的梯度时间内集中流出,则说明后续实验可采用等度洗脱。由梯度保留值范围比梯度时间可以估算等度条件下色谱柱及流速的保留值范围。例如,令最后被洗脱的组分和第一个被洗脱的组分保留时间之差为△tR,梯度时间为tC,当tR/tC=0.25时,对应的等度保留值范围为1<k'<10;当△tR/tC=0.40时,对应的等度保留值范围为0.5<k'<20。当等度保留值在0.5<k'<20范围之内时,可采用等度分离条件,等度分离的B%根据初始梯度条件下最后一个流出色谱柱组分的保留时间决定。
采用梯度洗脱时,以初始梯度实验第一个流出色谱柱组分对应B%作为推荐梯度的初始B%,以最后一个流出色谱柱组分对应的B%作为推荐梯度的最终B%。接下来可通过改变梯度实现样品的更好分离。
在初始条件下保留较弱的组分通常为以离子形态存在的碱性溶质(pPH=2~3),分离效果较差。对pKa<8的弱碱性溶质,可通过增大流动相pH值提高其保留值;但对碱性较强的溶质,则需加入磺酸盐离子对试剂增加其保留值。而对初始条件下难以洗脱的强保留组分,可采用四氢呋喃-水体系进行洗脱、非水反相分离或改成正相色谱模式进行分离。
向流动相中加入改性剂主要有两种方法。
(1)离子抑制法在反相色谱中常向含水流动相中加入酸、碱或缓冲溶液,以使流动相的PH控制一定数值,抑制溶质的离子化,减少谱带拖尾,改善峰形,以提高分离的选择性例如在分析有机弱酸时,常向甲醇-水流动相中加入19%的甲酸(或乙酸、三氯乙酸、H3PO4、H2SO4),就可抑制溶质的离子化,获对称的色谱峰。对弱碱性样品,向流动相中加入1%的三乙胺也可达到相同的效果。
(2)离子强度调节法在反相色谱中,在分析易离解的碱性有机物时,随流动相pH值的增加,键合相表面残存的硅羟基与碱的阴离子的亲和能力增强,会引起峰形拖尾并干扰分离,此时若向流动相中加入0.1%~1%的乙酸盐或硫酸盐、硼酸盐,就可利用盐效应减弱残存硅羟基的干扰作用,抑制峰形拖尾并改善分离效果。但应注意经常使用磷酸盐或鹵化物会引起硅烷化固定相的降解。
显然,向含水流动相中加入无机盐后会使流动相的表面张力增大,对非离子型溶质,会引起保留值增加:对离子型溶质,会随盐效应的增加引起保留值的减小。




















