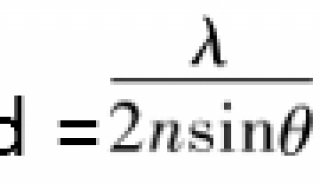NatMethods年中专题:定量生物成像
最新一期(7月)Nature Methods发布了今年年中的一项重要焦点专题:Bioimage Informatics,这一专题中包含一篇社论,一篇人物特写,以及多篇研究进展,其中也包含了来自国内学者的研究新成果。
随着以显微技术为基础的成像技术的发展,所获取生物成像信息数据的规模和复杂度也在快速增长中,从中提取更多定量数据的需求也在增多,这些都需要更加全面的成像和分析方法,以及软件工具。此次Nature Methods就以此为主题,收集了多篇文章,探讨生物成像信息在显微技术,可获取的特殊工具中的作用,以及这一研究领域所面临的挑战和机遇。
在首篇题为“The quest for quantitative microscopy ”的社论文章中,Nature Methods指出,通过数据信息,显微技术已经逐渐向着更加精确和更加有效的方向发展。
显微技术历来都是一个定性的工具,但是数字显微和摄像技术的发展,以及新型标记和成像技术,都促使这一技术领域更加容易获取到有意义的定量数据,计算机技术也是这一进程中的核心促进力量。显微技术朝着定量方向发展,将能带来重要的科学效益,用于更多的方面,性能和可重复性也得以提高。
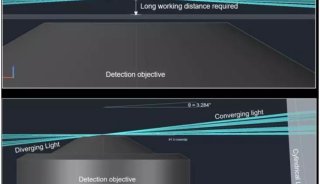
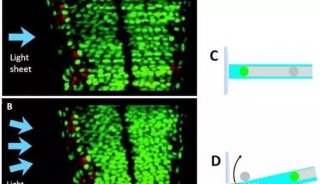
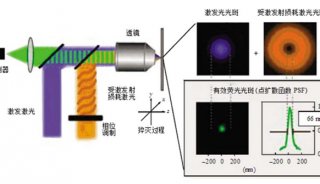
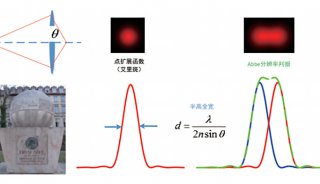
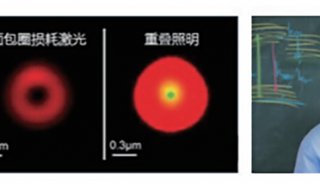
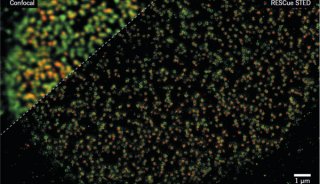
目前这一方面的主要限制在于精密光学方法无法充分得以应用,比如分析超高分辨率显微镜数据中的个别荧光基团的算法,还处于起步阶段,研究人员也缺少能工具,来从三位图像集中自动重构神经元网络,这些都阻碍了神经科学研究等领域的发展。
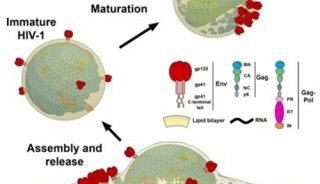
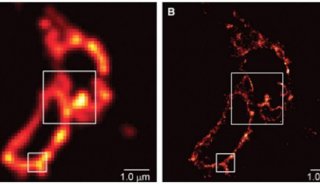
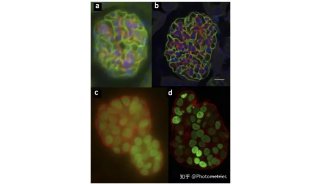
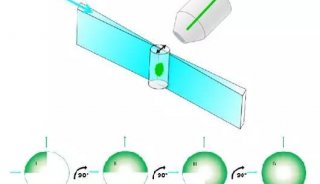
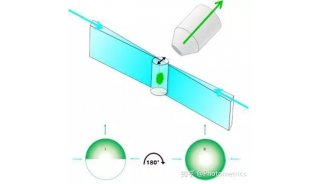
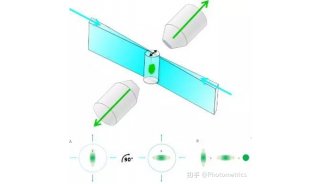
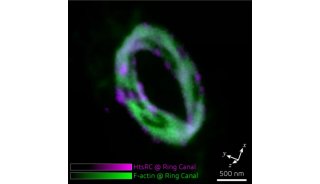
不少研究人员都在寻找解决这些问题的方法,比如在来自中国科学院生物物理研究所的研究人员就设计出了新型单体光活化荧光蛋白,这类荧光蛋白可应用于高分辨率显微镜中进一步改进活细胞成像。
这项研究找到了两个真正单体荧光蛋白:mEos3.1和mEos3.2。mEos2是目前使用最为广泛的PAFPs之一,但mEos2在高浓度下倾向于形成二聚体或多聚体,尤其当mEos2标记膜蛋白时会影响膜蛋白在细胞中的定位。
研究人员为了解决膜蛋白的标记问题,同时发展综合性质更佳的荧光蛋白探针,首先解析了mEos2的晶体结构,找到了引起mEos2在高浓度下寡聚的关键性氨基酸位点,然后对mEos2进行定点突变筛选,最终获得了两个真正单体荧光蛋白:mEos3.1和mEos3.2。进一步的研究显示,mEos3 具有成熟时间短、亮度高的特性。用于单分子定位时具有很高的标记密度和光子产出,在超高分辨成像中比当前所有PAFPs都表现出色。
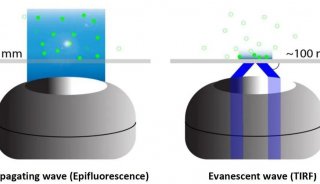
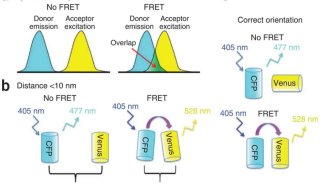
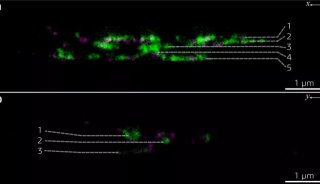
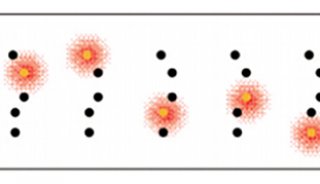
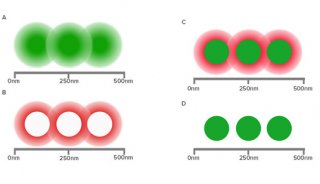
除此之外,还有单细胞显微成像的问题,传统的荧光显微技术在探索单细胞调控网络方面,是一个有力的工具,但是这种技术荧光基团光谱的重叠,限制了同时观察分子种类的数量。
来自加州理工学院的研究人员采用了一种简单有效的技术策略,解决了荧光显微技术中,无法同时观察多种分子种类的问题,让系统生物学进入单细胞时代。
研究人员利用了超高分辨率显微技术,并结合分子标记,极大的提高了单细胞中多重分子检测能力。近年来,超分辨率显微镜领域取得了大量的成果,空间分辨率不断提高,这些技术大大提高科学家们获得单细胞结构清晰图谱的能力。研究人员利用荧光原位杂交FISH制成一种独特的荧光基团组合,用以标记 mRNAs,解决了测序,和SRM荧光基团结合问题。通过实验,他们同时在单个酿酒酵母细胞中,同时分析了32个基因的mRNA表达水平。
这项研究证明结合标记,和超高分辨率成像技术,将能简单有效的让系统生物学进入单细胞时代。
-
项目成果
-
焦点事件

-
项目成果