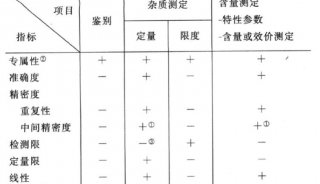
药典委:新版药典凡例、微生物限度检查法、生物制品草案
近日,国家药典委员会发布《凡例》、《微生物限度检查法》等5份国家标准草案,如下:
1107微生物限度标准
生物制品分包装及贮运管理
凡例
动物来源药用辅料生产和质量控制指导原则
鼠源性病毒检查法(4.荧光定量PCR法)

各标准文件内容如下:
1107 非无菌药品微生物限度标准
非无菌药品的微生物限度标准是基于药品的给药途径和对患者健康潜在的危害以及药品的特殊性而制订的。药品生产、贮存、销售过程中的检验,药用原料、辅料及、中药提取物及中药饮片的检验,新药标准制订,进口药品标准复核,考察药品质量及仲裁等,除另有规定外,其微生物限度均以本标准为依据。
1.制剂通则、品种项下要求无菌的及标示无菌的制剂和原辅料 应符合无菌检查法规定。
2.用于手术、严重烧伤、严重创伤的局部给药制剂应符合无菌检查法规定。
3.非无菌化学药品制剂、生物制品制剂、不含药材原粉的中药制剂的微生物限度标准见表 1。

表1 非无菌化学药品制剂、生物制品制剂、不含药材原粉的中药制剂的微生物限度标准
4.非无菌含药材原粉的中药制剂微生物限度标准 表 2。
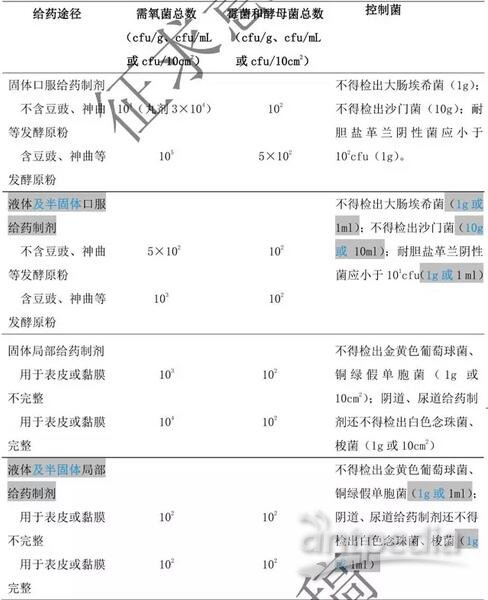
表 2 非无菌含药材原粉的中药制剂的微生物限度标准
5.非无菌的药用原料及辅料的微生物限度标准见表 3。

表 3 非无菌药用原料及辅料微生物限度标准
6.中药提取物及中药饮片的微生物限度标准见表 4。
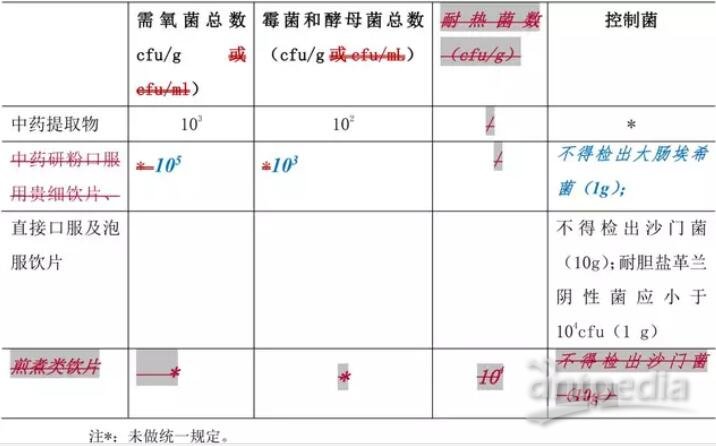
表4 中药提取物及中药饮片的微生物限度标准
7.有兼用途径的制剂 应符合各给药途径的标准。
8.除中药饮片外,非无菌药品的需氧菌总数、霉菌和酵母菌总数照“非无菌产品微生物限度检查:微生物计数法(通则 1105)”检查;非无菌药品的控制菌照“非无菌产品微生物限度检查:控制菌检查法(通则 1106)”检查。各品种项下规定的需氧菌总数、霉菌和酵母菌总数标准解释如下:
10^1cfu:可接受的最大菌数为 20;
10^2cfu:可接受的最大菌数为 200;
10^3cfu:可接受的最大菌数为 2000:依此类推。
中药饮片的的需氧菌总数、霉菌和酵母菌总数、耐热菌总数及控制菌检查照“中药饮片微生物限度检查法”(通则 xxx)检查;各品种项下规定的需氧菌总数、霉菌和酵母菌总数及耐热菌数标准解释如下:
10^1cfu:可接受的最大菌数为 50;
10^2cfu:可接受的最大菌数为 500;
10^3cfu:可接受的最大菌数为 5000:
10^4cfu:可接受的最大菌数为 50000:依此类推。
9. 本限度标准所列的控制菌对于控制某些药品的微生物质量可能并不全面,因此,对于原料、辅料及某些特定的制剂,根据原辅料及其制剂的特性和用途、制剂的生产工艺等因素,可能还需检查其他具有潜在危害的微生物。
10. 除了本限度标准所列的控制菌外,药品中若检出其他可能具有潜在危害性的微生物,应从以下方面进行评估:
药品的给药途径:给药途径不同,其危害不同;药品的特性:药品是否促进微生物生长,或者药品是否有足够的抑制微生物生长能力;
药品的使用方法;
用药人群:用药人群不同,如新生儿、婴幼儿及体弱者,风险可能不同;
患者使用免疫抑制剂和甾体类固醇激素等药品的情况;
存在疾病、伤残和器官损伤;等等。
11. 当进行上述相关因素的风险评估时,评估人员应经过微生物学和微生物数据分析等方面的专业知识培训。评估原辅料微生物质量时,应考虑相应制剂的生产工艺、现有的检测技术及原辅料符合该标准的必要性。