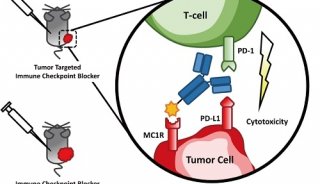
Nature子刊: 不同肿瘤类型对PD-L1阻断反应的分子决定因素
靶向PD-1/PD-L1轴的免疫检查点抑制剂可在多个适应症的癌症患者亚群中产生持久的临床应答,包括非小细胞肺癌(NSCLC)、尿路上皮癌(UC)和肾细胞癌(RCC)。在此,作者对366例患者的PD-L1免疫组化(IHC)和肿瘤突变负担(TMB)与RNA-seq进行了补充,以确定统一的和适应症特异性的分子谱,这些分子谱可以预测这些肿瘤类型对检查点封锁的反应。多种机器学习方法未能识别出一个基线转录特征,该特征对这些适应症的反应具有高度预测作用。前面描述的免疫检查点抑制剂的签名也没有通过验证。在通路水平上,在适应症之间观察到显著的异质性,特别是在PD-L1+肿瘤中。mUC和NSCLC是分子对齐的,与PD-L1肿瘤应答相关的细胞周期和DNA损伤修复基因。在基因水平上,CDK4/6抑制剂CDKN2A被确定为应答的重要转录相关因子,突出了非免疫途径与检查点封锁结果的关联。交叉指征分析揭示了mucc、NSCLC和RCC肿瘤之间的分子异质性,提示应优先考虑针对指征的分子途径来制定治疗策略。

图片来源:https://doi.org/10.1038/s41467-021-24112-w
癌症治疗的发展,如化学疗法或激素疗法,传统上专注于特定的肿瘤类型。最近,针对细胞毒性t淋巴细胞相关蛋白4 (CTLA4)和程序性细胞死亡蛋白1 (PD-1)或其配体PD-L1的免疫检查点抑制剂(CPIs)在各种癌症类型中显示出持久的临床反应,包括黑素瘤、非小细胞肺癌(NSCLC)、局部晚期或转移性尿路上皮癌(mUC)和肾细胞癌(RCC)。然而,只有一小部分患者对CPIs有持久的反应。为了使患者获益最大化和毒性最小化,需要新的生物标志物来识别CPI单药治疗的应答者,并为无应答者提供联合治疗方法。然而,目前还没有一种生物标志物能够有效地跨越不同肿瘤类型。
在某些肿瘤类型中,肿瘤细胞(TC)和肿瘤浸润性免疫细胞(IC)的PD-L1表达均增加,可能对患者有反应。此外,随着适应症的不同,肿瘤突变负担被提出作为CPI反应的独立生物标志物。推测,突变率增加导致新抗原负荷增加,从而使新抗原特异性CD8+T细胞具有抗肿瘤活性。在免疫丰富的肿瘤中,T细胞基因表达特征最近也与PD-1阻断后的更好的结果相关。此外,将TMB与肿瘤微环境(TME)中的PD-L1表达7或CD8+T细胞信号相结合,可以丰富对检查点封锁的应答者。最后,pembrolizumab获批用于高水平微卫星不稳定性患者(DNA错配修复受损导致微卫星不稳定),证明了在非常小的患者群体中存在一种泛肿瘤生物标志物。这些发现强调了需要更可靠的生物标志物来预测对CPI的反应和主要耐药性。

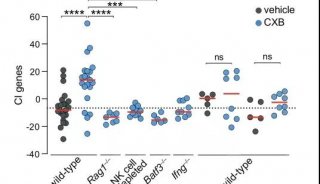
PD-L1+(上热图)和PD-L1(下热图)分别是肿瘤
图片来源:https://doi.org/10.1038/s41467-021-24112-w
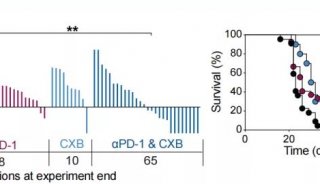
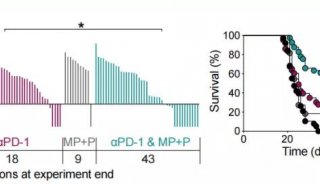
在这项研究中,作者通过RNA-seq对366名患者的PD-L1表达和TMB进行转录分析,以确定在三种对抗PD-L1单克隆抗体atezolizumab有反应的肿瘤类型中与CPI反应相关的分子程序。
这项交叉指征分析结合了572名接受atezolizumab治疗的患者的现有生物标志物和RNA-seq,显示了mucc、NSCLC和RCC肿瘤之间显著的分子异质性。机器学习没有识别出一个统一的转录签名预测ORR。多种因素决定了对检查点封锁的反应,而这些因素在一定程度上依赖于肿瘤类型,这突出了在这一领域开发生物标志物的难度。虽然对PD-(L)1阻断反应的通用生物标志物可能存在,但考虑适应症特异性的分子环境来制定下一代联合治疗将是至关重要的。
-
项目成果