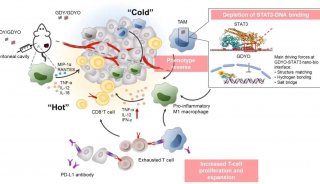
将“冷”肿瘤转变为“热”的免疫治疗机制,未来可期!
免疫疗法在肿瘤治疗中的地位越来越重要,仅仅在2021年的前5个月FDA新批抗肿瘤适应症中免疫治疗就占据了半壁江山。
但是如果我们仔细观察就会发现,免疫治疗的“排头兵”——免疫检查点抑制剂批准的适应证往往集中在几个癌种中,例如膀胱癌、头颈部肿瘤、肾癌、肝癌、黑色素瘤和非小细胞肺癌等。
为什么会出现这样的现象呢?
已有的研究告诉我们,在免疫检查点抑制剂的治疗过程中,治疗疗效与预先存在于肿瘤内的T细胞免疫和特异性炎症通路的激活有关。
这些特征主要包括更高的细胞毒性淋巴T细胞浸润(CTL)、肿瘤突变负荷(TMB)、新抗原负荷以及γ干扰素(IFN-γ)信号。而高的T细胞浸润肿瘤相对来说更容易响应免疫检查点抑制剂的治疗带来更好的预后。这些肿瘤也被学界称之为“热”肿瘤。
有“热”肿瘤,自然也有“冷”肿瘤,所谓“冷”肿瘤,其实就是对免疫检查点抑制剂耐药的肿瘤。
那么有没有办法能让这些“冷”肿瘤变“热”呢?
近日,曼彻斯特大学研究团队发现,单药使用环氧合酶2(COX-2)抑制剂或者前列腺素2(PGE2)的受体拮抗剂,都可以激活 IFN-γ驱动的转录重构,并协同免疫检查点抑制剂提高效应T细胞在瘤内的积累[2]。研究发表在《癌症发现》杂志上。
这意味着,常用的抗炎药,有可能能够成为免疫治疗的一大助力!

COX-2及其下游的一种酶产物前列腺素PGE2与癌症的关系其实早有研究,它俩在癌症中上调,并与恶性肿瘤生长的多个方面有关。PGE2被证明在肿瘤免疫逃逸中起主导作用,而COX-2也被认为与“热”肿瘤中相关的多种炎症调节因子的表达具有负相关性。
COX抑制剂是常用的抗炎药。这样一类安全性已经被证实过的常用药物,如果能用于癌症治疗,吸引力实在是太大了。
既然COX-2和PGE2已经在基因层面证实了其与肿瘤免疫微环境的相关性,为什么不能试一试把COX-2抑制剂和免疫检查点抑制剂联用起来呢?
依靠着这样一个构想,研究者们开始了他们的实验。
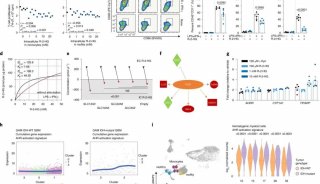
他们发现,相较于野生型,在结肠癌CT26细胞以及低免疫原性的乳腺癌4T1细胞中,COX-2敲除的小鼠表现出了对抗PD-1治疗的高响应性。而在COX-2敲除的4T1小鼠中恢复COX-2表达,使其正常生成PGE2,小鼠又表现出了对抗PD-1治疗的抵抗性。
在确定了这条通路的激活确实能辅助免疫检查点抑制剂治疗之后,研究者吃下了一颗“定心丸”,下一步的目标可以转向抗炎药物了。
首先是非甾体抗炎药,研究者选择了一种选择性的COX-2抑制剂塞来昔布。为了精确控制给药剂量和给药时间,研究者采用了一种新剂型,降低了以往研究中可能存在的试验误差。
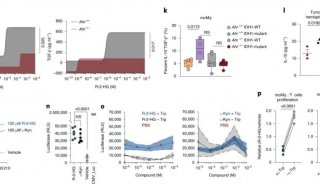
研究者将人体的有效耐受剂量转换至小鼠中得到30mg/kg这个数值,并联合抗PD-1药物给药,发现联合用药小鼠相较于两药分别单药给药小鼠的肿瘤抑制程度更高,有高达65%的比例达到了抑制肿瘤进展以及显著的生存获益,小鼠的生存率也大大增加了。
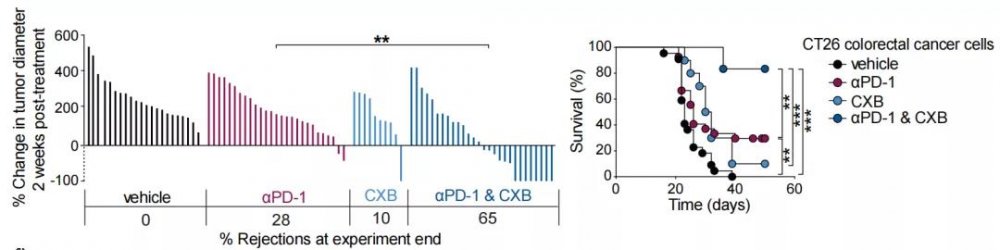
联用塞来昔布可以提升免疫治疗效果
如果说到抗炎药物联用,其实最有发言权的并不是非甾体抗炎药,而是糖皮质激素药物。超过50%的免疫检查点抑制剂治疗中会发生严重的免疫相关不良反应(irAE),而针对严重的irAE,临床上会选择停用免疫检查点抑制剂的同时加用糖皮质激素药物。而糖皮质激素发挥抗炎作用的通路之一就是COX-2——PGE2。
于是研究者同样对糖皮质激素的协同作用进行研究,发现联合5天的甲强龙治疗序贯3周的泼尼松治疗比起单药治疗可以增加CT26小鼠的肿瘤根治率以及生存期。
同时为了排除抗炎治疗是否起到了独立于免疫系统之外的肿瘤治疗作用,研究者又使用了免疫缺陷鼠模型进行研究,发现抗炎治疗对免疫缺陷鼠并无获益。
在我们的刻板印象中,包括控制irAE在内的糖皮质激素的作用往往是与免疫治疗背道而驰的,那么在联用后肿瘤消除小鼠中停止治疗会不会造成肿瘤复发呢?研究者进行了进一步观察同时发现并没有这样的现象,这说明抗炎药物并不会对机体的长期免疫造成破坏。
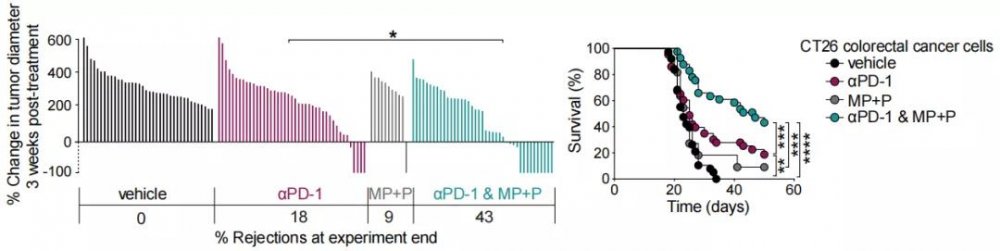
联用糖皮质激素也可以提升治疗效果
研究者还分析了PGE2受体拮抗剂是否能和COX-2抑制剂一样协同免疫检查点抑制剂的治疗。结果发现PGE2受体拮抗剂也可以通过干扰素γ等炎症相关免疫通路协同免疫治疗。
到了这一步,研究者想要更加确定什么样的联用方案会对免疫治疗疗效增强更有利,那么就需要找到最适药物以及确定用法用量。
除了下游的PGE2之外,COX-2还可以合成多种炎症介质,包括白三烯、血栓烷和其他具有促肿瘤或抗肿瘤功能的前列腺素。那么怎样才能避免这些脱靶效应呢?研究者转向了PGE2的受体——EP2和EP4,这两个受体的抑制剂也同样被证实有免疫治疗协同作用,同时也证明了COX-2/PGE2/EP2-4轴为靶点的药物可以改变肿瘤微环境,并增强免疫抑制剂的疗效。
那么用法用量怎么确定呢?研究者发现PGE2的抑制带来的免疫增强仅仅需要4h就能实现,然而来的快,走的也快,这表明肿瘤免疫微环境具有显著的可塑性,其维持需要持续的治疗性COX-2抑制,并可能每天给药两次或三次,以最大限度地发挥其对免疫检查点抑制剂的协同作用。
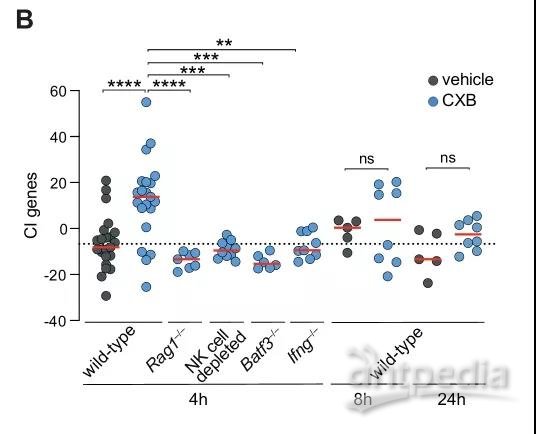
相较于未联用塞来昔布组,塞来昔布终剂量4h后有显著疗效,8h及24h无显著疗效
到了这里,COX-2抑制剂的免疫协同作用还未在人体中得到验证。研究者通过使用最近开发的PDTF(源于患者的肿瘤片段)进行药效研究,塞来昔布的加入减少了如IL6或CXCL1等致瘤前介质的产生,同时增强了CXCL9和CXCL10的释放,而这两个是IFN-γ驱动的细胞毒性T细胞的促进因子,对自然和治疗诱导的抗肿瘤免疫至关重要。
将“冷”肿瘤转变为“热”肿瘤,为免疫治疗疗效提升提供条件,不同于目前常见的增强免疫方案,将免疫逃逸的通路进行限制也是一种选择,而抑制这条通路的还是一种现成的抗炎药物,应用潜力巨大,未来可期!
-
科技前沿

-
焦点事件

-
投融资

-
焦点事件

-
科技前沿
-
科技前沿

-
会议会展

-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿
-
科技前沿

-
科技前沿

-
技术原理

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件

-
项目成果
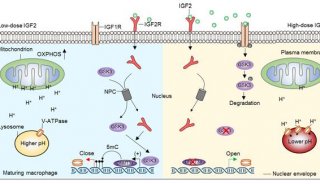
-
项目成果
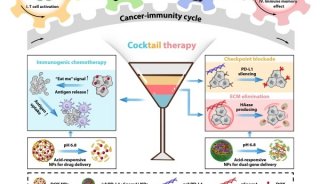
-
焦点事件

-
焦点事件
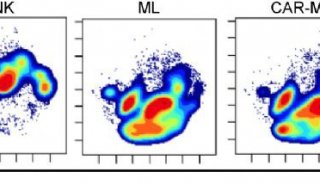
-
焦点事件

-
焦点事件

-
焦点事件

-
科技前沿
-
焦点事件

-
焦点事件
-
项目成果
-
项目成果
-
产品技术
-
项目成果
-
产品技术
-
产品技术

-
焦点事件

-
科技前沿

-
科技前沿