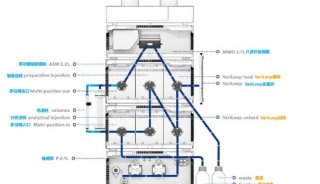
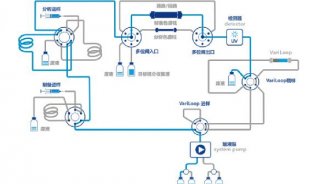
xCELLigence 系统内源性GPCRs 细胞功能研究(二)
材料与方法
细胞系与培养条件:细胞系来自于ATCC。按照 ATCC 的建议进行HeLa(#CCL-2)、U2OS
(#HTB-96)、SH-SY5Y(#CRL-2266)、CHO-K1 (#CCL-61)、人血管内皮细胞(HUVEC;#
PCS-100-010 批号 58570370)与混合肾原代上皮细胞(MREC;ATCC # PCS-400-012 lot #
58488854)的培养,肿瘤细胞系传代至 10 代以上,原代细胞系传代至 4 代。
检测程序:所有检测均于组织培养器(5%
CO2,37°C )中进行。细胞培养基为生长培养基,细胞接种密度是 1-2 x 104 细胞每孔,接种于96孔E-Plates
中,并通过xCELLigence 系统进行过夜监测,直至细胞生长至接近满板,复孔检测。预先在另一普通96孔板中每孔中添加 2 µl
药物,并储存于 -20℃。待细胞培养 18-24 小时后,进行药物稀释反应。将药物融解,并添加 132 µl 检测缓冲液(1 x
HBSS,Sigma H8264、20mM HEPES,Cellgro 25-060-Cl、0.1% BSA,Fisher Scientific
#BP1600)对其进行稀释处理。从培养箱中移除 E-Plates 96,使用检测缓冲液进行洗涤,洗涤一次,并使用Biotek
MicroFlo Select,于每孔中添加 140 µl 检测缓冲液。将 E-Plates 96 放回至RTCA MP 站,放置15
分钟,进行细胞平衡。然后使用 Beckman Multimek 96,同时在各孔添加10 µl的药物缓冲液。小分子药物实验最终浓度为10
µM,多肽为1 µM。
数据分析:使用 RTCA 软件,对每孔的数据在药物添加前时间点进行标准化处理。对于各种药物,在计算时需减去只含药物溶剂时对照细胞表现出的背景值。小分子药物相应溶剂为DMSO,多肽药物相应溶剂为0.1% 的BSA 。
将检测结果数据导出至Microsoft
Excel,进行后续计算。确定每孔细胞的最大与最小细胞指数值,计算重复检测(n=2)的均值标准差与平均值。对于对照孔细胞来说,对重复检测 8
个孔的均值标准差进行测定。将这些数值平均并乘以 3 以计算“hit”阈值。对于 Z 因子与 EC50 计算来说,使用RTCA
MP提供的动态反应曲线,选择一时间点作为细胞系及药物综合反应的最佳时间点。
结果
为确保研究的重现性,细胞为可靠来源,并可确保细胞的质量与类别。所有实验细胞均来自于美国细胞菌种库(ATCC)。检测前,进行有限传代,按照 ATCC 的建议进行细胞的保存。
内源性GPCR检测稳定性。检测各种条件下HeLa细胞对内源性GPCRs激活剂的反应性。且将钙离子载体
A23187作为阳性对照,并对其进行检测。低浓度情况下,由于 Gq-偶联 GPCR
的激活,A23187可模拟钙离子的活化过程。由于其独立于GPCRs的表达,这种反应有助于细胞检测条件的研发。最强烈反应出现于过夜长满平板的细胞。此时使用
GPCR 检测通用缓冲液更换掉生长培养基(参见详细检测条件中的材料与方法)。
按照这些检测条件对几种不同细胞系对 A23187
与1-磷酸鞘氨醇(SIP)的反应进行评价,SIP 是无所不在的 GPCR
表达家族、溶血磷脂或内皮分化基因(EDG)受体的内源性激活剂。Z量测因子考虑有信噪比与检测的变异性,用于对检测强度进行评价(3)。使用终浓度 1
µM 或与缓冲试剂(0.1% BSA)相同浓度的 S1P 与 终浓度 100 nM 或与其缓冲试剂(DMSO)相同浓度的 A23187 对 8
个重复多孔培养的细胞进行处理。使用xCELLigence 系统,对细胞反应进行实时监测,间隔时间1分钟。
激活剂添加后最初几分钟期间,即开始检测细胞反应。每种细胞系中,添加激活剂后的最初 30-40 分钟期间细胞反应最大(参见图
1)。如图所示,处理后接近 30 分钟时,HeLa 细胞对A23187 的反应最大,对S1P 的反应接近最大。此时,A23187 与 S1P 的
Z 因子分别是0.83与 0.90。所检测的细胞类型中,两种处理中至少一种 Z 因子分值超出0.5,表明检测可靠性高(参见表
2)。相反,两种配体混合的原代肾上皮细胞(RMEC) Z 因子接近 0.25,表明检测可靠性不显著。但后续 GPCR
筛查检测结果表明,该细胞类型其他 GPCRs 可靠性更高。

图 1:GPCR 检测可靠性评价。HeLa 细胞接种密度是 10000 细胞每孔,接种于E-Plate 96 上,放置于xCELLigence RTCA MP 仪器,并在培养箱中过夜。然后去除生长培养基,添加检测缓冲液,持续细胞监测 15 分钟后,添加 GPCR调节药物,记录每分钟细胞反应情况,记录 1.5 小时。获得时间依赖性细胞反应曲线。八复孔,误差列代表均值标准差。药物添加后 30 分钟,计算单一时间点 Z 因子值检测质量。DMSO 是 A23187 试剂对照;0.1% BSA 用于 S1P。SD = 标准差;ABS = 绝对值。


图 2:GPCR 检测灵敏性评价。如图 1 方法,对 HeLa 细胞进行检测,每种药物以8个浓度处理细胞。使用 RTCA 软件,通过计算药物添加30分钟后每种药物的EC50值,对检测灵敏性进行测定。
内源性GPCR检测灵敏性。我们也使用 A23187 与 S1P,以及 8 点剂量反应曲线检测实验灵敏性(参见图 2)。于 Z 因子测定相同时间点,通过 RTCA 软件计算产生 50% 最大反应(EC50 值)的激活剂浓度。
每种细胞系的 EC50 值见表 2。每种细胞对 A23187 的处理均比较敏感,除CHO-K1外,所有细胞类型对 S1P
的处理均非常敏感,产生的 EC50 值低限为 10-7 至 10-9。尽管 CHO-K1 细胞表达EDG 受体(4),后续检测S1P
与溶血磷脂酸(LPA)反应分值为阳性(见下文),但是为生成准确的 EC50,很明显,这里所用的剂量不足以饱和生物反应。

表 2:检测开发与评价概述