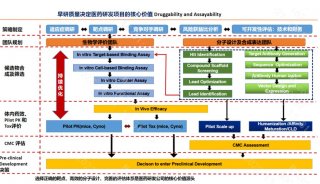
肺癌新药中国临床开发门槛提高
以PD-(L)1为代表的免疫检查点抑制剂和靶向疗法的出现不仅变革了肿瘤临床治疗方式,显著延长了癌症患者生存时间,也改变了医生评估癌症治疗效果或处理不良事件的方式,同时也使人们对癌症有了更全面的认识。
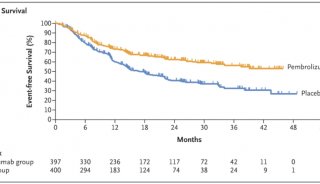
晚期非小细胞肺癌(NSCLC)患者的标准治疗药物也逐渐从曾经的化疗药转变为肿瘤免疫治疗。监管方的审查标准也日趋严格,信达PD-1信迪利单抗出海失败的原因之一就是由于其关键临床研究(Orient-11)没有将总生存期(OS)作为主要终点,而仅将无进展生存期(PFS)作为主要终点。
而正在开展的治疗晚期NSCLC临床试验方案的设计也在悄然发生着变化,细心的读者或许已经发现了,近日康方生物合作伙伴Summit Therapeutic在clinicaltrials.gov网站登记了一项PD-1/VEGF双抗Ivonescimab(依沃西单抗)联合化疗 vs. Keytruda(K药,帕博利珠单抗)联合化疗一线治疗转移性鳞状非小细胞肺癌的III期研究(HARMONi-3),而该试验的主要终点已变为OS,PFS则退居为关键次要终点。
接下来,本文将从涉及局部晚期(III期)或转移性(IV期)鳞状NSCLC这一细分适应症的临床治疗药物变迁和临床试验主要终点的变化一窥日益增高的肿瘤药开发竞争壁垒(注:由于篇幅有限本文提及的研究以及适应症均仅包含涉及晚期鳞状NSCLC,单独批准非鳞状NSCLC的适应症不纳入讨论范围)。
从化疗到免疫治疗,鳞状NSCLC治疗药物迭代
在2015年3月4日Opdivo(纳武利尤单抗)获FDA批准之前,鳞状NSCLC的标准二线治疗药物为多西他赛。基于III期CheckMate -017研究和II期CheckMate -063研究结果,Opdivo获FDA批准上市,用于治疗在铂类化疗期间或化疗后进展的晚期(转移性)鳞状NSCLC。至此,开启了非小细胞肺癌PD-(L)1肿瘤免疫治疗时代[1],而O-K大战也在NSCLC领域打响。
2015年10月2日,Keytruda凭多中心、开放标签、I期多队列KEYNOTE-001研究获FDA加速批准上市,用于治疗含铂化疗期间或之后疾病进展,且肿瘤表达PD-L1转移性NSCLC患者,成为了首个被批准用于鳞状和非鳞状转移性NSCLC的PD-1疗法[2]。2016年10月24日,基于II/III期KEYNOTE-010研究结果,FDA对Keytruda二线治疗NSCLC进行标签更新,批准其用于治疗肿瘤表达PD-L1(TPS为1%或更高)且在含铂化疗期间或之后疾病进展的转移性NSCLC患者[3]。
2015年10月9日,基于III期CheckMate -057研究结果,Opdivo扩展适用人群至非鳞状NSCLC患者,从而实现二线治疗转移性NSCLC人群全覆盖,并且无论PD-L1表达如何[4]。
在Opdivo和Keytruda获批二线NSCLC适应症一年后,罗氏Tecentriq(阿替利珠单抗)凭III期OAK研究和II期POPLAR研究结果,获FDA批准上市,用于二线治疗局部晚期或转移性NSCLC,无论PD-L1表达如何[5]。
在中国,目前获国家药监局批准二线治疗鳞状NSCLC的药物仅有Opdivo(2018/6/15)和替雷利珠单抗(2022/1/5),信达曾主动撤回了信迪利单抗二线治疗鳞状NSCLC的上市申请[6]。
在晚期NSCLC二线治疗获得成功后,PD-1开始向一线治疗前移。K药和O药自然也是率先实现突围。2016年10月24日,基于III期KEYNOTE-024研究结果,Keytruda获FDA批准一线治疗肿瘤PD-L1高表达(TPS≥50%),EGFR/ALK基因突变阴性NSCLC[3],成为了首款获批治疗转移性NSCLC一线治疗的PD-1药物;之后,Keytruda再次获FDA批准新适应症,联合卡铂和紫杉醇一线治疗鳞状NSCLC,无论PD-L1表达如何(2018/10/30),以及单药一线治疗肿瘤表达PD-L1 (TPS≥1%)、EGFR/ALK基因突变阴性、局部晚期或转移性NSCLC(2019/4/11)。
2020年5月,Opdivo联合Yervoy(伊匹木单抗)获FDA批准一线治疗肿瘤表达PD-L1(≥1%),EGFR或ALK基因突变阴性、转移性NSCLC,成为首个获得FDA批准的双重免疫疗法。10天后,Opdivo联合Yervoy(伊匹木单抗)和两个周期化疗获FDA批准,一线治疗EGFR或ALK基因突变阴性、转移性或复发性NSCLC,无论PD-L1表达如何,成为了首个不考虑PD-L1表达情况,同时适用于鳞状或非鳞状疾病患者的一线疗法。
在此之后,阿替利珠单抗、西米普利单抗、度伐利尤单抗相继获FDA批准用于局部晚期或转移性NSCLC一线治疗。
2019年9月30日,基于包括了中国亚组及中国扩展队列数据的III期临床试验KEYNOTE-042结果。Keytruda在中国获批,单药用于PD-L1肿瘤比例分数(TPS)≥1%, EGFR/ALK阴性的局部晚期或转移性NSCLC一线治疗,成为了首个在中国获批用于晚期鳞状和非鳞状NSCLC一线治疗的PD-1抑制剂(Keytruda于2019年4月在华获批联合培美曲塞、顺铂一线治疗EGFR和ALK阴性的转移性非鳞状NSCLC)。
2021年开始,国产PD-1相继获批局部晚期鳞状NSCLC一线治疗,截至目前,获批局部晚期鳞状NSCLC一线治疗的国产PD-1包括替雷利珠单抗、信迪利单抗、卡瑞利珠单抗、舒格利单抗、斯鲁利单抗以及派安普利单抗。
总的来说,无论是晚期鳞状NSCLC一线治疗还是二线治疗,均是国外PD-1打头阵,之后国产药物相继获批,在批准时间上相差了4年多。其次,当Keytruda、Opdivo等外企产品已在晚期一线治疗中取得成功后,PD-1二线对病人的获益及商业意义较小,因此,国产PD-1大多转向一线治疗,获批产品数量也显著增加。
另外,目前Keytruda、Opdivo已经在早期乳腺癌的辅助治疗或新辅助治疗中获得FDA批准,国产PD-1尚未在这类患者中获得批准,后续我们将持续关注。
从ORR到PFS和OS,鳞状NSCLC治疗药物主要终点的变化
经过上文的梳理,我们已经非常清楚,目前晚期鳞状NSCLC标准治疗药物已经从化疗转变为PD-(L)1。观察这些药物,不难发现,它们循证证据中临床试验主要终点也有非常大的差异。
CheckMate -017研究中,Opdivo在二线治疗晚期(转移性)鳞状NSCLC时已经将OS作为主要终点。Keytruda虽然晚于Opdivo获批,不过由于针对的是肿瘤表达PD-L1转移性NSCLC患者人群,因此,只凭I期KEYNOTE-001研究ORR和缓解持续时间(DoR)数据便获得了FDA加速批准。KEYNOTE-001研究是一项无缝拓展队列临床试验,该项适应症曾获得了FDA突破性疗法认定。
在此之后,无论是Keytruda的II/III期确证性研究,还是阿替利珠单抗的III期OAK研究,主要终点均为OS;值得注意的是替雷利珠单抗也是将OS作为研究的主要终点。
晚期NSCLC一线治疗方面,国内外临床试验对于主要终点的设置则出现较大的差异。Keytruda作为首款获批一线治疗治疗转移性NSCLC的PD-1,其最开始的一项关键III期KEYNOTE-024研究的主要终点为PFS,OS是次要终点。在此之后,无论是扩适应症还是修改标签,对应研究的主要终点均包含OS。
Opdivo联合Yervoy一线治疗转移性NSCLC的CheckMate 227研究和Opdivo联合Yervoy以及化疗的CheckMate -9LA研究也是将OS作为主要终点。后续获FDA批准一线治疗晚期NSCLC的药物阿替利珠单抗、西米普利单抗、度伐利尤单抗/tremelimumab联合疗法均是基于III期研究OS终点获FDA批准。
而国内获批一线治疗局部晚期或转移性鳞状NSCLC的国产PD-1的主要终点仍为PFS,尚无药品基于OS终点获批。这也可以看出国内外监管审批门槛的差异。
不过,随着同一适应症获批产品越来越多,无论是监管机构从患者获益的角度考量还是药品开发企业基于市场竞争的考虑,创新药开发不仅要做头对头研究,更需要将OS作为研究的主要终点的趋势已经愈发明显。
从目前国内药品针对鳞状NSCLC开展的注册性临床研究来看,虽然还没有企业像Summit Therapeutic既做头对头研究,并且将主要终点定为OS。不过多家国内企业已经开展了头对头III期研究。
康方生物启动了依沃西单抗联合化疗 vs 替雷利珠单抗联合化疗一线治疗鳞状NSCLC的III期研究,主要终点为PFS;齐鲁开展了PD-1/CTLA-4双抗QL1706联合化疗 vs 替雷利珠单抗联合化疗一线治疗PD-L1表达阴性、局部晚期或转移性NSCLC的III期研究,并将PFS和OS作为了共同主要终点;康方生物同样于近日启动了AK104(卡度尼利单抗)联合化疗 vs 替雷利珠单抗联合化疗一线治疗PD-L1表达阴性NSCLC的III期研究,主要终点也为PFS和OS。
给我们的启示
通过以晚期鳞状非小细胞肺癌相关适应症获批情况、试验设计情况以及目前正在开展的多项研究分析,我们非常清晰地发现,无论是国外还是国内,创新药开发门槛在提高。头对头研究已经成为一个趋势,关键III研究主要终点的设置也在慢慢发生变化,PFS作为主要终点已经成为必须,未来将发展为OS为主要终点。这也进一步说明,作为创新药开发企业,必须开发出疗效更优的产品才能在急剧“内卷”的竞争环境中脱颖而出。