一例肝脏占位2周诊断分析
临床资料
患者男性,49岁,因发现肝脏占位2周入院。
既往:乙型肝炎病史10余年。
查体:全身皮肤黏膜无黄染,浅表淋巴结未触及肿大。腹软,无压痛及反跳痛。肝脾肋下未触及,肝区叩击痛阳性。
辅助检查:入院时肝功能正常。
外科综合提示:抗-HBs、抗-HBe、抗-HBc阳性。余化验结果未见明显阳性。
肝胆胰多排CT平扫+三期增强(图1)可见:肝右叶见团块状低密度影,大小约6.4cm×
5.0cm,CT值约25~43 HU,不均匀强化,肝内胆管未见扩张。

影像诊断为:肝右叶占位性病变,首先考虑胆管细胞癌。
经全科讨论后,患者于2015年1月20日在全麻下行右半肝切除术。术中见肝右叶有一大小约8cm×7cm的不规则肿物,凸出肝脏表面,局部侵犯膈肌。同时见肝门区、腹主动脉旁可触及数枚肿大淋巴结。行既定术式,分离肝门解剖结构,留置肝门预阻断带,同时清扫肝门区淋巴结,间断阻断肝门后顺利切除右半肝。剖开切除组织见肝脏肿物实性,大部分呈灰白色,局部有红褐色组织。家属过目后送检病理。
术后病理回报结果如图2,伴大面积坏死,局限于肝被膜内。体积8.5cm×7cm×4.5cm,脉管可见肿瘤浸润,神经未见明确肿瘤浸润,切缘未见肿瘤浸润,周围组织呈中度肝炎G3S2改变。
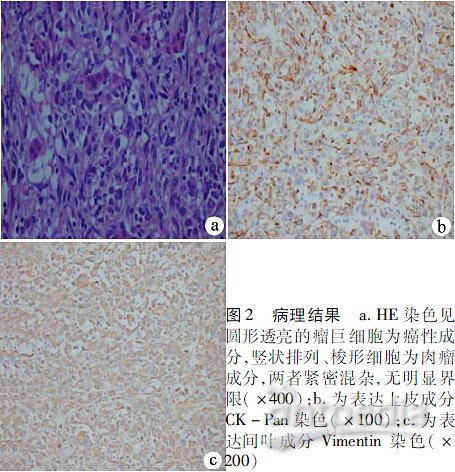
免疫组化结果:CD34阴性,CK-Pan阳性,Ki-67 60%阳性,CK19部分阳性,GPC-3阴性,HepPar1阴性,Vimentin阳性。
请大家根据以上信息讨论:1.该患者的诊断是什么?2.您会如何安排治疗?
答案公布
最终诊断为肝癌肉瘤(carcinosarcoma,CS)
讨论
CS常见发生于乳腺、甲状腺、胃肠道和呼吸道等,而原发于肝脏十分少见。至今为止,国内外关于原发性肝脏癌肉瘤(primary hepatic carcinomasarcoma,PHCS)病例少有报道,通过查阅文献统计约42例。2000年,世界卫生组织将CS单独列为肝脏间叶源性肿瘤的一种,并且定义为由癌样成分(无论是胆管或肝细胞)和肉瘤样成分紧密混杂在一起的恶性肿瘤。PHCS以中老年男性(46~84岁)多见,平均60岁。肿瘤位置在肝脏右叶多见,肿瘤直径从4~23cm不等,平均12.1cm。与其他肝细胞癌患者相比,其临床症状并无特异性的临床表现。患者甲胎蛋白一般不高,也有个别病例升高。
普通超声对CS诊断缺乏特异性,超声造影、CT、磁共振成像(MRI)对该病的诊断有一定价值。杨炼等认为,CT平扫表现为肝脏实质内巨大囊实性肿块,肿块实性部分呈条状分隔或结节状散在分布。肿块密度高低不均,可以液体密度为主;CT增强扫描示实性成分呈不均匀强化,未见明显强化。MRI表现多为T1WI上呈低信号为主,T2WI上呈高信号为主的混杂信号;强化比较明显且不均匀,多为延迟强化。超声、CT及MRI对肝脏肿瘤大小、位置及良恶性有初步判断,但需要与原发性肝癌、肝脏肉瘤及肝腺瘤相鉴别。病理诊断及免疫组化是确诊PHCS的金标准:
(1)病理诊断:PHCS在镜下观察可分为两部分,即癌成分和肉瘤成分。两者之间界限清楚,无移行过渡。肉瘤成分:肉瘤区域呈束状、编织状排列,高倍镜下肿瘤细胞呈现梭形、异型不规则;癌成分:癌细胞呈圆形,部分胞质透明,中等大小,核仁明显胞浆丰富,核分裂多见,瘤巨细胞多见(图2a)。
(2)免疫组化:根据细胞来源不同,其表达的肿瘤标志也不尽相同。CS中肉瘤成表达间叶成分标志,癌成分表达上皮细胞标志(如CK、癌胚抗原、上皮的胞膜抗原等)。远处转移灶及附近区域淋巴结内除有上皮性癌成分外,也可见肉瘤样组织,从而说明肉瘤样组织并非由上皮组织化生而来,证明了他们的肿瘤特性。同时尽管CS组织中同时含有癌及肉瘤成分,但是有时癌组织很少,大部分为肉瘤样成分。因此切片应多处取材及做免疫组化。只有明确证实有上皮成分,或者至少肉瘤样组织周围要有原位癌、重度异型增生的上皮组织,才可以诊断为癌肉瘤。否则就要同肉瘤如平滑肌肉瘤、恶性神经鞘瘤等作鉴别诊断。
CS的组织来源目前仍存在争论。对其来源目前国内外主要有4种观点:
(1)胚胎残留学说(来源于器官内残余的胚胎组织);
(2)碰撞学说(两个原发的癌和肉瘤相邻,在生长浸润中相遇);
(3)间质诱导学说(癌成分刺激和诱导其间质成分发生增生并出现异常);
(4)全能干细胞学说(具有多向分化潜能的完全未分化状态的细胞,形成肿瘤时会有不同胚层的多种组织成分)。
因此,对于CS的起源也有不同的观点。Fayyazi等及Nomara等分别根据2例不同的尸检及免疫组化的结果提出了各自不同的观点。Nomara等认为CS成分是由上皮化生而来的。Fayyazi等认为CS起源于全能干细胞。本例患者也有相同的免疫组化结果,即CK、vimentin两者染色均为阳性,因而笔者支持CS的肉瘤成分是由全能干细胞分化而来的观点。
本病罕见,且恶性程度极高,能手术切除的尽量手术切除。Yamamoto等一项统计36例PHCS病例的研究显示患者平均生存期为8.7个月。由于恶性程度高,其预后比肝细胞癌和胆管细胞癌均差,尽管通过手术切除,仍然容易出现转移。最常见的为肝内转移,发生率高达70%。但是,通过对患者术后长期随访得知,其平均生存期为12.6个月。同时,笔者认为在肝脏恶性肿瘤手术时,尽量要求行规则肝段、叶切除,术中尽量减少对肿瘤组织挤压,而且保证切缘距离肿瘤不少于2cm。对于无法手术或者手术切除不净的患者,可以建议经肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)。华西医院一宗28例CS对照研究表明,TACE可以延长其生存期。Yamamoto等病例对照研究中显示化疗(包括顺铂、卡铂、丝裂霉素C等)和放疗可以改善患者临床症状,但对患者总体生存期影响不大。生物治疗是目前新兴发展技术,笔者推测使用综合治疗包括手术、术后TACE,生物治疗及放化疗可能有效延长患者生命。该例患者由于经济原因拒绝行TACE及生物治疗,术后3个月复查时发现腹腔淋巴结转移。分析患者3个月复发原因考虑有以下3点:
(1)患者术前影像学检查提示肝门、腹腔淋有多发增大淋巴结,但无法确定是肿瘤引起炎症反应导致淋巴结反应性肿大,还是出现淋巴结转移。目前对于肝脏肿瘤淋巴结清扫范围无明确规定,在实施外科手术时,一般按胆道肿瘤清扫肝门及十二指肠区域淋巴结,而对于腹主动脉旁及肠系膜根部淋巴结清扫较少,处理起来也比较棘手。术中清扫肝门区淋巴结,未扩大清扫其他区域淋巴结,可能与预后有关。
(2)患者术后未进行介入栓塞、生物治疗等抗肿瘤综合治疗,对于血液、淋巴结等微小灶甚至癌细胞未起到控制甚至杀灭作用。
(3)原发性癌肉瘤本身恶性程度较原发性肝细胞癌、胆管细胞癌高,其预后差。
针对于此,如果临床术前怀疑CS患者,可术前行病理穿刺或者术中快速病理。如确诊,则应行扩大淋巴结清扫,无法清扫的淋巴结予以标记,以便术后放疗。生物治疗作为一种新兴发展技术,大部分免疫治疗方法处于临床研究阶段,部分取得令人鼓舞进步。尽管索拉非尼在治疗肝癌细胞、赫赛汀在治疗乳腺癌及其转移中已取得较好的临床疗效,但是应用生物治疗原发性癌肉瘤暂时未见报道。因病例数少,该肿瘤的诊治和预后等方面的特点,仍然需更多病例数的积累和研究以进一步明确。







