蛋白质和多肽反相HPLC分析和纯化指南(十一)
HPLC-MS
联用的两个重要因素是电喷射接口的最佳流速及三氟乙酸对肽电离的影响
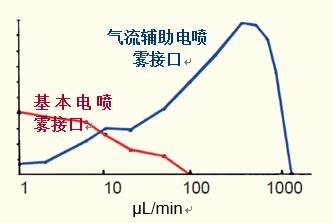
基本电喷雾接口的信号在5~10μL/min的流速区间上迅速下降(图28)。
这与采用标准分析型HPLC柱的流速不相容。
目前,商用电喷雾提供一种高剪切流氮气辅助的电喷雾(气流辅助电喷雾),它将电喷雾的最佳流速区间提升到了200~500μL/min。
这仍然低于标准分析柱通常所用的最佳流速,因此,目前科学家在使用HPLC-MS时,普遍采用流速为200~300μL/min的细孔柱(内径~2 mm)
图28. 红线表示基本电喷雾接口流速与信号响应的关系。蓝线同样表示气流辅助电喷雾的信号响应。
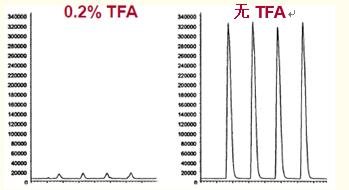
如图29所示,流动相中的TFA流入电喷雾接口导致蛋白质和多肽的信号减弱。
这是由于TFA和多肽间强烈的相互作用将多肽中和。
图29. 使用电喷雾接口时,TFA的流入会大幅减弱多肽的信号。
有两种方法可纠正由TFA引起的信号减弱:
忽略信号损失。通常,当信号足够强大时,即使信号减弱也仍能获得有用的数据。在这种情况下可以忽略信号损失。
当信号损失过多时,最佳的解决方案是将高纯度硅胶柱与低浓度TFA结合使用。
高纯度硅胶柱与低浓度TFA一同使用仍能维持较好的峰形(图30)。
采用高纯度硅胶柱能得到良好的信号响应和峰形。
其它方案包括用甲酸代替TFA或柱后采用乙酸或丙酸代替TFA。
但采用甲酸得到的峰形不如TFA,分离度也不如TFA,因此会影响性能。
这在蛋白质组学应用中可以接受,但在蛋白质治疗药物中不可行。
柱后替换TFA较为棘手,且会导致分辨率下降。
图30. 高纯度硅胶与低浓度TFA一同使用,保持肽的峰形。
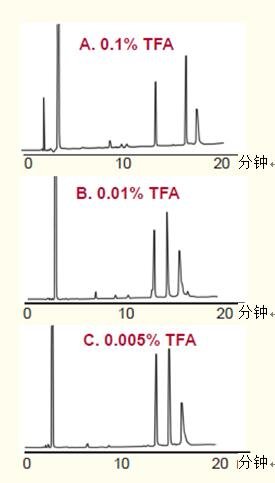
色谱柱:ACE 5 C18, 4.6 x 250 mm(高纯度硅胶)
洗脱液:加入如图所示的TFA,以10%-55%的乙腈(ACN)梯度洗脱,洗脱时间为37.5分钟。