蛋白质和多肽反相HPLC分析和纯化指南(十四)
蛋白质/多肽液相分析中的流动相选择
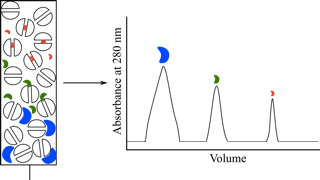
有机溶剂可将吸附在疏水界面的蛋白质洗脱(图14)。
在梯度洗脱期间,当有机溶剂量达到针对每一蛋白质的特定浓度时,蛋白质就会从疏水界面上解吸,继续顺着柱向下,从而从柱中洗脱。
图14. 当有机改性剂的浓度达到特定值时,蛋白质从疏水界面洗脱。
乙腈。在多肽的反相色谱分离时最常用的有机溶剂为乙腈。为什么选择乙腈?
乙腈易挥发,易从样品中去除。
乙腈黏度低,柱压低。
乙腈的紫外吸收截止波长较短。
乙腈长期用于分离应用。
异丙醇。异丙醇在多肽的色谱分离中具有重要作用。尽管异丙醇黏度大(会增大柱压),很少单独用作有机改性剂,但其在提高一些多肽的回收率方面具有重要作用,尤其是强疏水性蛋白。
在此类情况下,以1%~5%的恒定浓度加入异丙醇,以提高疏水性多肽的回收率或洗脱。
其它有机改性剂。很少使用甲醇或乙醇等有机改性剂,除非在分离强疏水性蛋白时。此外,由于乙醇毒性低,因此还用于蛋白质的大规模纯化。
梯度洗脱。多肽的洗脱几乎都采用梯度洗脱法,采用梯度洗脱法分离时,逐渐增大有机溶剂的相对浓度。
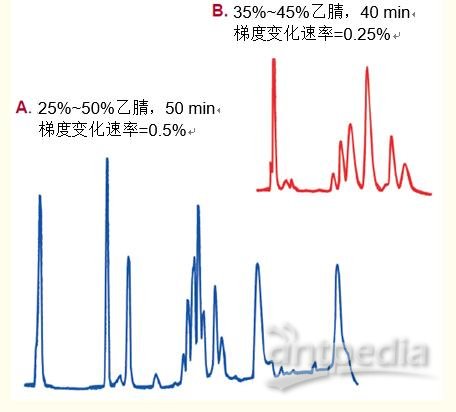
当有机改性剂的浓度升到解吸所需的特定浓度时,蛋白质和多肽就从柱上洗脱。如图15所示,有机改性剂的浓度(梯度)变化速率越慢,这些蛋白亚基的分辨率越高。
在该例中,相较于每分钟0.5%的梯度变化速率,每分钟0.25%的梯度变化显着提高了分辨率。
蛋白质/多肽的保留机制的图1中显示了采用每分钟0.15%的梯度变化速率时几种胰岛素的分离过程。采用每分钟0.05%的梯度变化速率洗脱时,分辨率最大。图15. 一般情况下,降低有机溶剂浓度变化速率会提高分辨率。
A. 细胞色素c亚基
B. 色谱图A中间片段的重现。
色谱柱:C4 宽孔柱, 4.6 x 250 毫米
降低梯度变化速率增加分辨率时,所需的分析时间必须尽可能短。
但是,梯度变化速率的调整在优化蛋白质和多肽的分辨率方面非常重要。
有时,降低梯度变化速率时,多肽会表现出特异行为(图16)。
分辨率有时不会按照预期增加,反而会降低,导致出现共洗脱,甚至洗脱顺序也会颠倒。
在图16的示例中,洗脱时间为45分钟时多肽11和12表现出最佳的分离效果。
当洗脱时间增加至90分钟时,多肽11和12间的分辨率降低;而当洗脱时间增加至160分钟时,出现共洗脱峰。
这种保留行为是多肽表面相互作用的结果,导致这种行为的原因目前尚不清楚。
因此,在进行多肽分离时,尤其是在分离蛋白酶水解物时,观察分辨率随梯度坡度降低的变化很重要。
如果分辨率未增加,反而降低,则必须优化梯度变化速率,以最大化整体分辨率。
图16. 多肽间分辨率有时随着溶剂浓度变化速率的降低(洗脱时间增加)而降低。
这将导致分辨率降低或共洗脱峰的出现,如人生长激素肽图中多肽11和12例示。
在一些情况下,多肽甚至会逆转洗脱顺序。
样品人生长激素的胰蛋白酶水解物。部分显示了多肽图谱。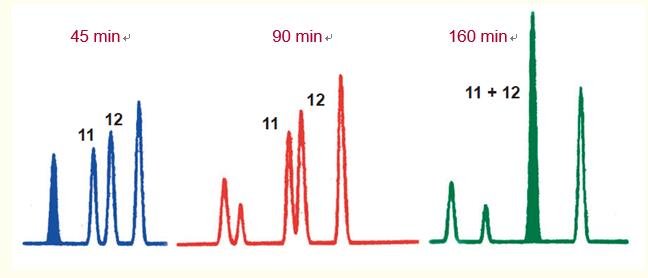
色谱柱:C18宽孔柱,4.6 x 150 mm
洗脱液:梯度:0~60%乙腈与水溶性溶剂和0.1%TFA混合液和有机溶剂与0.08%TFA混合液在一定时间内形成梯度洗脱。
蛋白质和多肽的反相色谱分析法需要“离子对试剂”。
在流动相中加入离子对试剂,以实现良好的峰形。
目前认为,在没有离子对试剂的情况下,硅胶表面的金属杂质是导致蛋白质/多肽峰形较差的原因。
三氟乙酸。三氟乙酸(TFA)是最常用的离子对试剂。将浓度为~0.1%的三氟乙酸加入流动相,会在大多数柱上产生良好的峰形(图17)。
降低TFA的浓度能提高LC-MS的检测灵敏度(见22~25页),但由于硅胶表面存在杂质,可能会导致硅胶柱上的峰形较差。
但采用高纯度硅胶柱时,可加入低浓度TFA(图17A——0.01% TFA)。
图17. TFA浓度对峰形和选择性的影响
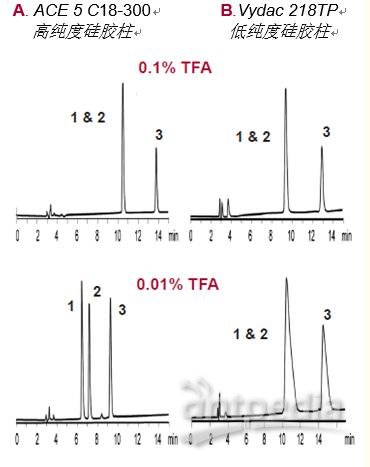
洗脱液:加入如图所示的TFA,以20%~32%的乙腈(ACN)梯度洗脱,洗脱时间为15分钟。
样品1.血管紧张素II 2.血管紧张素III3.血管紧张素I