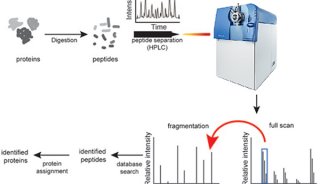
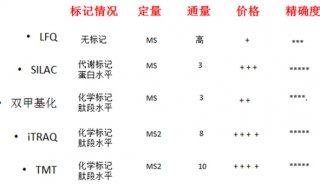
第三届全国生物质谱学术交流会隆重召开
上海交通大学系统生物医学研究院 张延研究员
来自上海交通大学系统生物医学研究院的张延研究员介绍了有关《蛋白质的O-糖基化修饰研究》的报告。
张老师首先指出糖链修饰是一种重要的蛋白质翻译后修饰,细胞内50%以上的蛋白质都有糖链修饰。糖链参与了细胞识别、细胞分化、发育、信号传导、免疫应答等各种重要生命活动。人类重大疾病如神经退行性疾病、心血管疾病、代谢性疾病、免疫性疾病以及肿瘤等均伴随有蛋白质糖基化异常的发生。因此蛋白质的糖基化修饰研究是蛋白质组学研究的重要内容。张老师主要通过研究 O-GalNAc糖基转移酶的糖基化修饰特性,通过利用UDP-GalNAc衍生物糖探针的荧光标记技术,结合质谱及多肽蛋白质芯片技术,建立了一种高通量发现蛋白质O-糖基化的新策略。
南京大学化学化工学院 梁靓老师
来自南京大学化学化工学院的梁靓老师介绍了题为《用于糖蛋白富集的团队硼亲和方法研究》的报告。
目前用于糖蛋白富集的主要方法有凝集素亲和法、肼化学法、亲水作用色谱法和硼亲和色谱法等。硼亲和方法与其他几种方法相比较具有三个显著的优点:1)共价结合,专一性好,亲和力强;2)可逆反应,结合/解吸过程容易控制;3)在酸性条件下解吸,解吸条件的质谱兼容性好。这些优点使得取代硼酸是非常理想的亲和配基,特别适合于以质谱为核心的蛋白质组学分析方法。然而,常规的取代硼酸具有两个明显的缺点:1)在中性pH下的亲和能力极弱,必须在碱性pH下才能与顺式二羟基化合物结合,这造成了操作上的不便,增加了样品变性的危险;2)在碱性pH时取代硼酸带负电,与样品及样品基体间存在静电相互作用,因而导致专一性的下降。
为了同时解决以上两个问题,梁老师所在课题组提出了“团队硼亲和”的原理以及相应的方法。利用该方法制备了团队硼亲和磁性纳米颗粒和团队硼亲和MALDI靶板,其优异的亲和力和专一性得到验证,成功实现了在中性pH条件下对糖蛋白的专一性富集和纯化。
应万涛副研究员 军事医学科学院放射与辐射医学研究所
题目:CD44s胞外区的N-糖基化修饰位点确认及糖链微不均一性表征