器官特异性血管遗传靶向技术及应用(二)
冠状血管内皮细胞中特异性基因操纵
心脏特异性血管中的基因敲除
VEGFR2(Kdr)在大多数器官的内皮细胞中普遍表达,过去要在冠状动脉中特异性靶向该基因几乎是不可能做到的,因此选择Kdr基因作为靶基因来验证CoER-Cre系统在条件性基因敲除中的应用。
通过Kdr flox小鼠与CoEC-Cre(Tie2-Dre;Wt1-CrexER)交配(图3A)。为了同时能够示踪,再引入R26-tdTomato报告基因小鼠。
敲除组为:Tie2-DRE;WT1-CrexER; Kdrflox/flox;R26-tdTomato小鼠;
同窝对照组为:Tie2-DRE;WT1-CrexER; Kdrflox/+;R26-tdTomato小鼠。
E14.5心脏切片免疫染色检测tdTomato、VEGFR2和CDH5,结果显示VEGFR2在tdTomato+ CDH5+冠状内皮细胞敲除组小鼠心脏的致密心肌内的缺失(图3B-D)。而在心肌小梁的心内膜细胞中,VEGFR2表达不受影响,表明CoEC-Cre重组特异性靶向表达Wt1的冠状内皮细胞,而不是心内膜内皮细胞(胚胎期不表达Wt1)。
心脏特异性血管中的基因过表达
选择人类白喉毒素受体(DTR)作为过表达基因。将CoEC-Cre与R26-iDTR小鼠杂交,其中DTR表达受Cre-loxP重组作用的控制(图3E)。可以通过白喉毒素(DT)处理来特异性消除表达DTR的冠状内皮细胞,从而验证这套系统在基因过表达中也是可行的。免疫染色显示仅在冠状内皮细胞中表达DTR(图3F);内皮细胞形态的严重破坏,说明细胞凋亡(图3G)。Tie2-Dre; Wt1-CrexER; R26-iDTR小鼠DT给药组和未给药对照组的心脏切片TUNEL+细胞数目有显著差异(图3H,I)。
综合上述基因敲除和过表达两个实验,表明新的基因靶向系统可以实现排它性地在冠状动脉内皮细胞中允进行基因操作,而不影响其他器官系统。
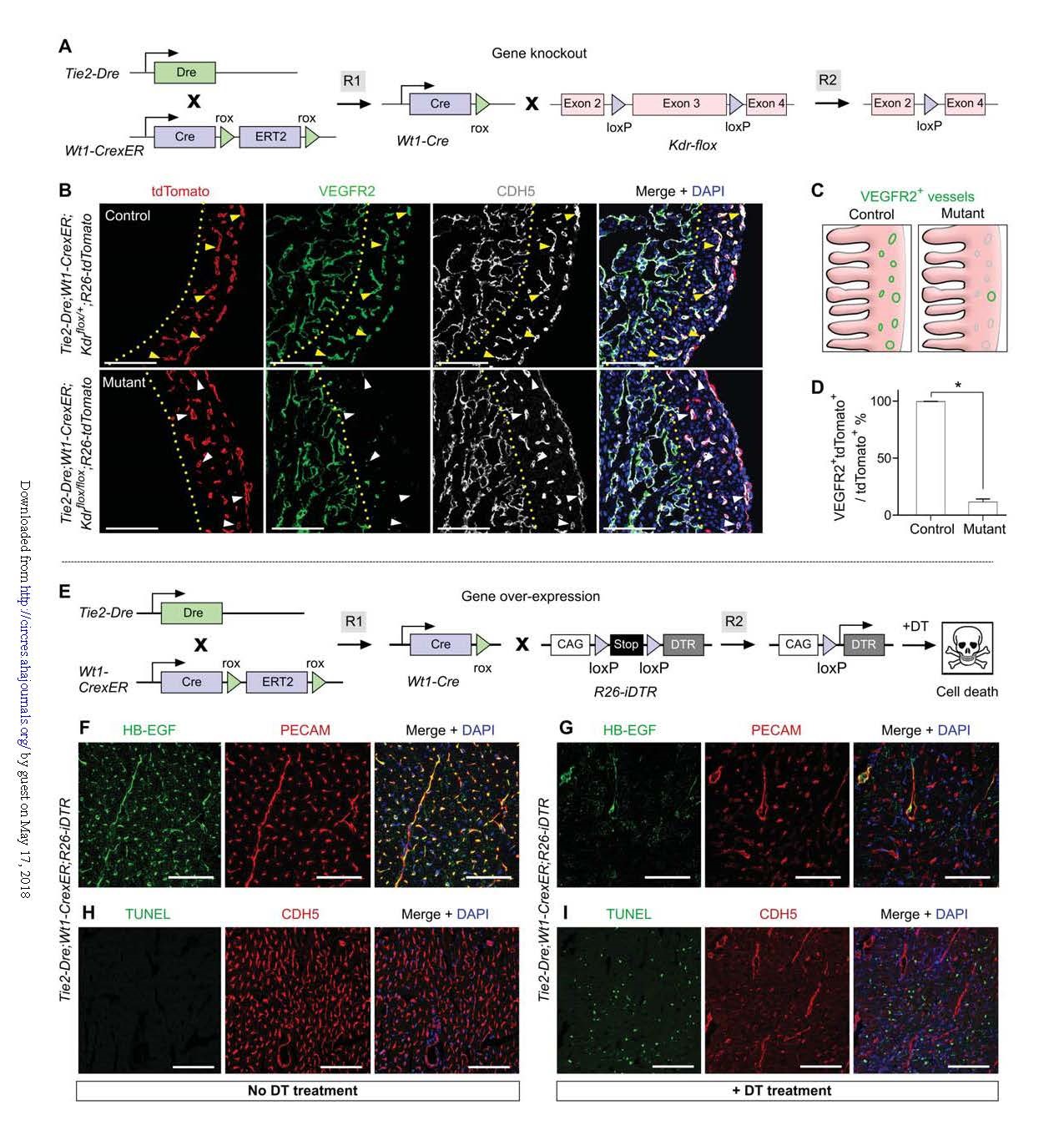
图3. Gene knockout and over-expression in coronary endothelial cells.
应用2:大脑内皮细胞特异性BEC-Cre
Tie2-Dre:同上文
Mfsd2a-CrexER:先前的研究表明Mfsd2a在脑内皮细胞中表达,但也在其他细胞类型中表达(图4A)。将编码CrexER的cDNA插入到Mfsd2a基因的第一个外显子的ATG位置,建立Mfsd2a-CrexER工具小鼠,并验证了该小鼠中CreER的表达。然后将Tie2-Dre工具鼠与之交配,获得Tie2-Dre;Mfsd2a-CrexER双阳性小鼠(以下称为BEC-Cre)(图4B)。
与常规靶向脑血管和神经元的Mfsd2a-CreER相比,BEC-Cre能够有效且特异地靶向脑血管,特异性优于Mfsd2a-CreER,而不标记任何神经元(图4C-E)。更重要的是,除了特异性,BEC-Cre相比传统的Mfsd2a-CreER,能够在脑内皮细胞中更有效地发挥Cre重组作用(图4E)。另外,BEC-Cre没有靶向任何门静脉肝细胞,也没有靶向其他器官或组织中的血管。tdTomato+内皮细胞在脑和其他器官或组织中的百分比定量统计也证实了BEC-Cre小鼠的效率和特异性(图4G)。

图4. Specific and efficient brain endothelial cell targeting。
脑特异性血管内皮细胞中的基因操纵
脑特异性血管中的基因敲除
同样地,再次使用VEGFR2(Kdr)作为靶基因,获得基因敲除组(Tie2-Dre; Mfsd2a-CrexER; Kdrflox/flox; R26-tdTomato)和同窝对照组(Tie2-Dre; Mfsd2a-CrexER; Kdrflox/+; R26-tdTomato)小鼠(图5A)。在新生小鼠大脑中,基因敲除组几乎检测不到VEGFR2+血管(图5B-C);而其他器官或组织中的血管中没有检测VEGFR2表达的降低,证明Kdr在脑血管中的特异性缺失。与对照组相比,基因敲除组中的血管密度显著降低(图5D);还观察到无血管区域的扩大,大脑缺氧的情况明显增加(图5E),证实脑血管密度降低对组织氧合的影响。除了减少的血管生成外,敲除组小鼠脑血管的形态异常(图5F)。
另外,通过注射10-kDa葡聚糖示踪实验以及tdTomato、红细胞标志物Ter-119、葡萄糖转运蛋白1(Glut1)免疫染色,发现毛细血管泄漏,证实Kdr缺失对血管完整性的影响(图6A-C)。而且,Kdr敲除组小鼠大脑内皮细胞蛋白质组成也发生了变化,BBB内皮细胞中显著诱导出了原本并不表达的质膜囊泡相关蛋白(PLVAP)(图6D)。在BEC-Cre介导的Kdr特异性敲除小鼠中,β-catenin(CTNNB1)的表达显着减少(图6E)。
综合这些结果,利用BEC-Cre介导脑血管特异性敲除,规避了常规全身Kdr敲除的胚胎早期致死,并证明Kdr是中枢神经系统血管生成所必需的。VEGF信号通路调节了与BBB内皮细胞完整性相关的基因。
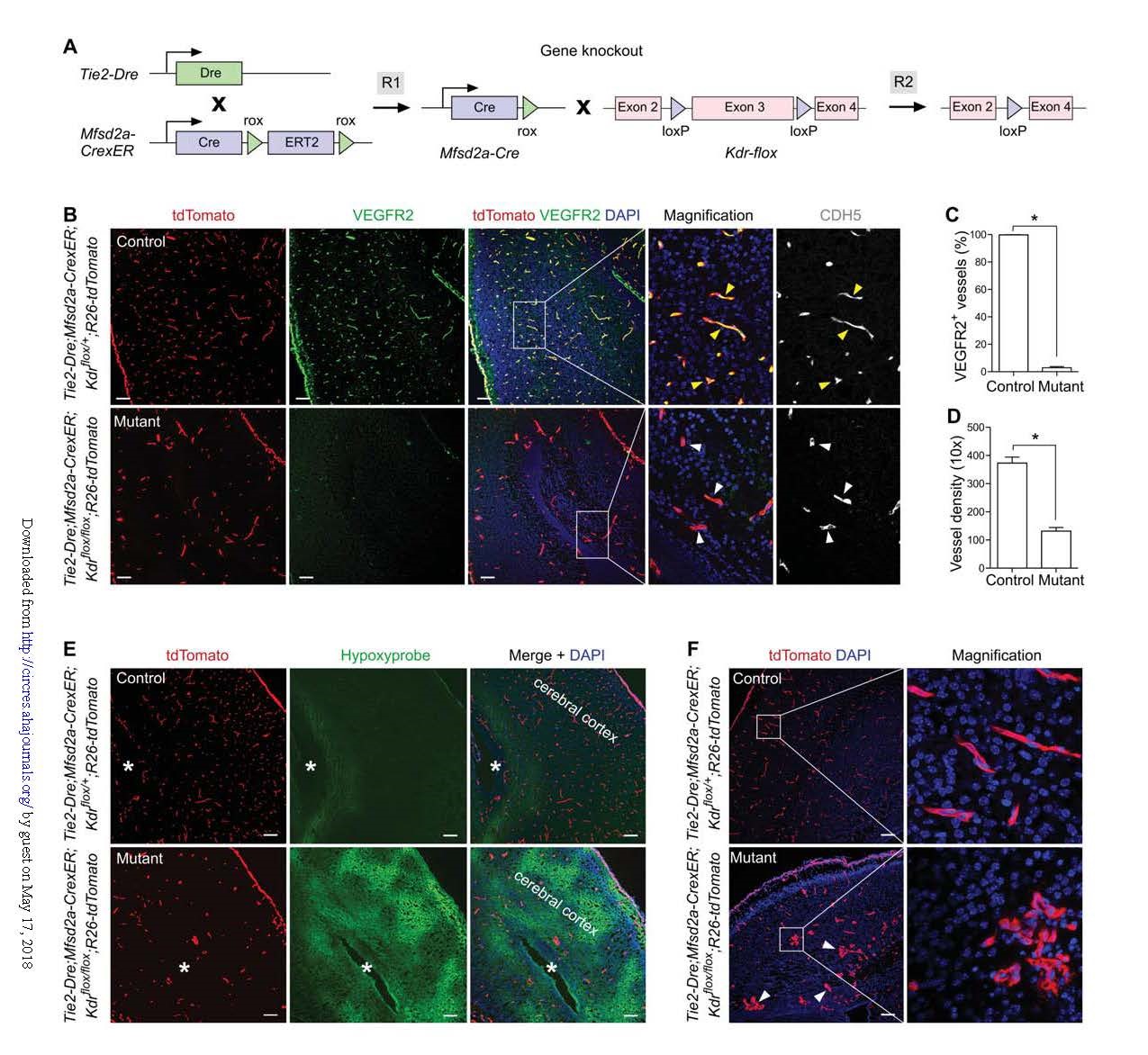
图5. Specific knockout of VEGFR2 in brain endothelial cells.
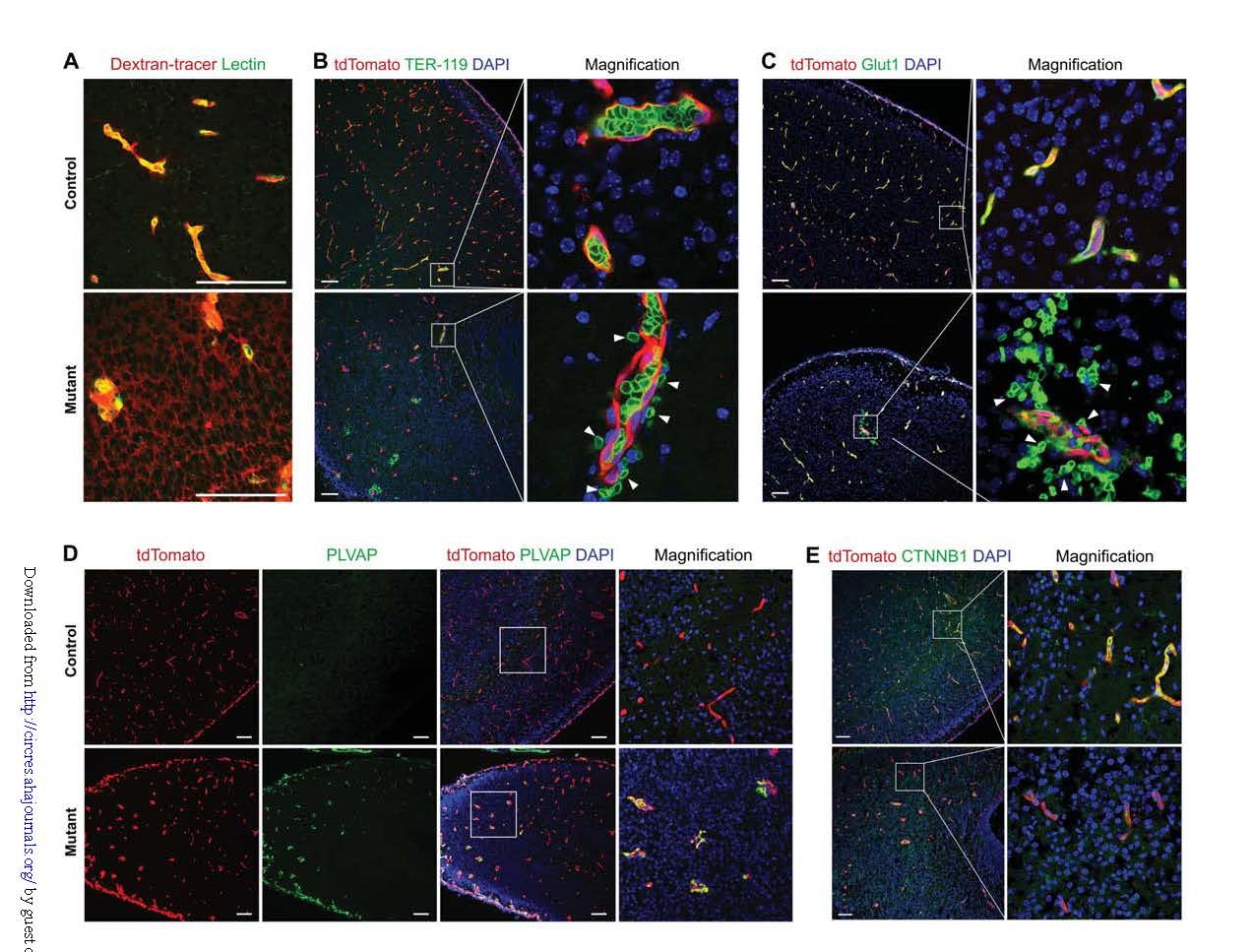
图6. Vegfa-Vegfr2 signaling regulates BBB integrity.
这项研究成功构建了心脏冠状动脉特异性Cre(CoEC-Cre)和大脑血管特异性Cre(BEC-Cre),并利用顺序交叉遗传靶向系统揭示了VEGF信号通路参与调控大脑血管新生及血脑屏障的形成。
随着 knockin 技术的日益普及,Cre工具鼠的建立已经变得越来越便捷;这也就使得特异性靶向的基因敲除与基因过表达可以变得越来越精细。
Dre与CrexER联用的这种新的顺序交叉遗传靶向系统可以实现在特定细胞群体中进行精确的基因操作,为组织特异性基因操作提供了一个有效的策略,可以广泛地应用到其他生物医学领域。是不是很妙呢?