等电聚焦和二维凝胶电泳实验(一)
试剂、试剂盒 样品缓冲液羟乙基二硫化物细胞裂解缓冲液SDS-PAGE 现成溶液二硫苏糖醇碘乙酰胺
仪器、耗材 等电聚焦电泳系统二维SDS-PAGE 多凝胶系统恒温循环器IPG 干胶条溶胀盘上样杯旋转摇动混合器
实验步骤
一、等电聚焦的基本原理
等电聚焦 (IEF) 是一种能根据分子内的质子接受点的 pKa 值所决定的电荷量分离两性分子 (如蛋白质和肽类) 的电泳分离方法。对于蛋白质和肽类而言,这些点位可以位于 N 端和 C 端的自由氨基及羧酸,也可以位于精氨酸、赖氨酸、组氨酸、天冬氨酸和谷氨酸残基的侧链。等电点是两性分子特有的物化参数,它是分子净电荷为零时的 pH。等电聚焦具有极高的分辨能力,包括分离能够改变电荷的蛋白质翻译后修饰 (如磷酸化作用、乙酰化作用/去乙酰化作用)。虽然这一方法可应用于若干类型的两性复合物的分离,但章节将只讨论蛋白质分离的方法论。
等电聚焦电泳样品的制备需要高浓度离液剂、两性离子去污剂、还原性巯基及载体两性电解质,以防止在蛋白质之间形成聚集物和复合物。制备高分辨率的等电聚焦电泳, 必须确保样品中不存在非蛋白质离子,因为需要保证高电阻以在最小电流的状态下产生高电场 (8000~10000V)。通常用蛋白质沉淀法减少此种污染物 (见本章 3.2 节)。理想情况下,等电聚焦电泳样品中的唯一离子便是蛋白质本身。随后,该样品便用于含有与样品相同添加物的等电聚焦凝胶中,并在电场中分离。在蛋白质到达其等电点后,将凝胶孵育在 SDS 缓冲液中,再根据蛋白质表观分子质量,用 SDS-PAGE 平板凝胶进行分离(分子质量是主要影响因素, 但也受到疏水性影响, 并且蛋白质形状也有着较小影响)。
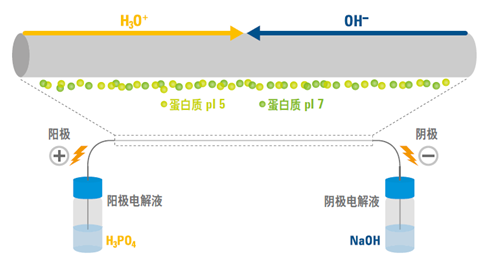
用于二维凝胶电泳的现代等电聚焦法采用薄聚丙烯酰胺凝胶作为分子筛,该分子筛具有固定的 pH 梯度(IPG)。这种凝胶中的丙烯酰胺浓度较低(丙烯酰胺总量通常为 4%~5%), 因为此基质不能对高分子质量蛋白质有所限制。将蛋白质加入此基质中,再加上电场。在 pH 梯度上低于 (也就是酸性强于)自身 pi 的蛋白质将带正电荷,并向电场的阴极移动。相反地,在 pH 梯度上碱性强于自身 pi 的蛋白质将向电场的阳极移动。Pl 表示蛋白质电中性时的 pH,因此当蛋白质在 pH 梯度上的值等于 pi 时,不受电场影响。
这样一来,蛋白质便会停止移动,并且牢牢保持在与自身 Pl 相等的 pH 处。这一方法具有得天独厚的聚焦效果—当蛋白质从其 Pl 点处扩散时,便会带上电荷,从而电场又会迫使其移回等电点。
在等电聚焦过程的最后,蛋白质便会高度聚集在其等电点上,因此探测时灵敏度非常高。即使是微小的电荷差异也能区别开,并且可以采用更大的分离距离和更小的梯度间隔来提高分辨率 (HovingetaL,2000)。如有需要,还可以用蛋白质标准品标定校准曲线来估计蛋白质的等电点。
等电聚焦的 pH 梯度类型
1.载体两性电解质
在由自由溶液中的混合两性缓冲液构成的 pH 梯度中分离蛋白质这一概念,是由 Vesterberg 和 Svensson(1966) 提出的,Vesterberg 在几年后便将这一概念转化为可行的方法 (VeSterberg,1972)。由于自然形成的氨基酸和多肽在其等电点时具有很弱的缓冲能力,所以缓冲液需要通过化学方法进行合成。
Ampholines(两性电解质) 是首批以此为目的而投入市场的试剂,该试剂是脂肪族寡氨基酸和寡碳酸的混合物,包含 600~700 种不同的同系物,这些同系物的等电点为 pH3~10。这些复合物在等电点时具有很强的缓冲能力,并能在电场的作用下形成 pH 梯度。混合物的分子质量小于 IkDa 时最适宜,并且因为高亲水性不会与蛋白质结合。
等电点范围明确后,将有助于提高 pH 梯度相差较小的混合物的分辨率。
载体两性电解质是近年发展起来的,与 Amphonlines 试剂相比,它们是由不同种的试剂合成的,并可从多种商业渠道中购得。尽管这些产品都能在电场作用下形成 pH 梯度,但它们的 pH 梯度具体分布、缓冲力的分布以及同系物数量却是不同的(Righettietal.,2007), 因此它们的聚焦模式也不尽相同。
基于载体两性电解质的等电聚焦大多是在聚丙烯酰胺凝胶中进行的,O’Farrell(1975) 提出的最初的二维凝胶电冰过程在薄凝胶管 (一维时为柱状胶) 中的载体两性电解质梯度中完成等电聚焦。但是这些长软型的凝胶不易操作,且随着电泳时间增加,pH 梯度也会变得不稳定, 从而引起阴极漂移。虽然一些实验室仍然采用载体两性电解质技术,但是这一技术方法大多被 IPG 胶条所替代,我们将在下面讨论 IPG 胶条。
2.固定的 pH 梯度
随着用于等电聚焦的聚丙烯酰胺基质中固定 pH 梯度这一概念的引人,二维凝胶电泳在方法论上有了重要的发展(Bjellqvistetal.,1982)。这一重要的技术发展克服了载体两性电解质系统的一些不足, 如梯度漂移 (特别是在阴极区)、机械不稳定性以及不同次电泳之间和实验室之间的技术差异。IPG 胶条技术极大地推动了二维电泳方法论, 并大大提高了实验室内部及不同工作组间的重复性 (Gorgaal.,2000;2004),如今已经成为等电聚焦的备选方法,并可从一些商业渠道获得。
在现代 IPG 胶条技术中,pH 梯度是由酸性和碱性缓冲组组成的。这些缓冲组是在制备凝胶时与聚丙烯酰胺基质共聚合而成的。只需要不到 10 种不同的具酸性和碱性 PKa 值的丙烯酰胺衍生物便足以获得任意的 pH 梯度。需要制备 2 种含有计算好的丙烯酰胺衍生物混合体的单体溶液: 酸性梯度端溶液的制备需加入一部分甘油用以在倒胶时稳定梯度。这些 PH 梯度凝胶的铺制是以共价结合的薄膜衬底为支撑的。在凝胶制备完成后,需用蒸馏水将聚合催化剂和非反应混合物从介质中洗去,以便产生等电聚集所必需的极低电导 (Westermeier,2005)。
IPG 胶长期保存时需干燥,并需在使用前不久进行再水化处理。IPG 胶的主要好处在于不存在阴极漂移问题,因为梯度是固定于基质上的。IPG 胶主要应用于变性条件下的等电聚焦,作为高分辨率二维凝胶电泳的第一维所使用; 其中仍然使用载体两性电解质,并且为了提高导电性和蛋白质的溶解度,在样品中和 1PG 胶的再水化溶液中都要加人载体两性电解质。
如今可以从一些供应商处购买到预制的 IPG 胶条,这些胶条具有各种长度和 PH 梯度,可以实现蛋白质裂解产物中选定的蛋白质组分的最优化分离与呈现。尤其是,胶条的 pH 梯度有非常宽的范围 (如 pH3~11),有中间范围 (如 pH4~7、pH7~11),还有狭窄范围 (如 pH4~5、pH5.5~6.5)。胶条长度同样非常多样,短至 7 cm, 长至 24 cm。典型胶条宽度为 3 mm,平均厚度约为 0.5 mm(图 30.2)。为了实现预期实验目的, 需要挑选具有最优 pH 范围和长度的胶条 (Hovingetal.,2000)。例如,7 cm、pH3~11 的 IPG 胶条可以为小样式凝胶提供最好的范围,但是总体来说,它们为蛋白质组范畴的、基于探索性质的实验提供的分辨率和灵敏性是最低的。
IPG 胶条提供几种样品上样模式。再水化上样和杯状上样是两种主要使用的方法,还有主动再水化的修改方法和纸桥上样(图 30.3)。本章 3.3 节和 3.4 节对这些方法有非常具体的介绍。样品上样方法的选择取决于 pH 梯度的类型和样品。因为 IPG 胶条有一个平整的表面, 所以如果需要, 可以应用于水平平板 SDS 凝胶电泳。