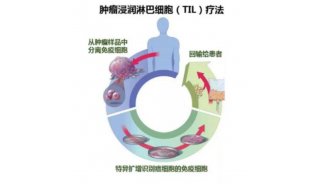
全球首款实体瘤TIL疗法获批上市,沪上企业竞相布局新赛道
2月17日,美股上市公司Iovance Biotherapeutics宣布,美国食品药品监督管理局(FDA)加速批准了其肿瘤浸润淋巴细胞(TIL)疗法Amtagvi,用于治疗晚期黑色素瘤。这是全球首款获批上市的TIL疗法,也是细胞疗法首次被证明可应用于实体瘤的治疗。2月19日晚间,在一场行业会议上,复旦大学附属肿瘤医院妇瘤科主任吴小华称,这是具有里程碑意义的,“说明细胞治疗实体瘤的路已经走通,下一步就是如何把这条路走得更宽、更广。”
沙砾生物联合创始人、CEO刘雅容对记者称,总体上,在肿瘤浸润淋巴细胞(TIL)疗法这一新兴技术领域,中国与海外TIL成药的差距已缩短至2年以内;部分产品甚至还有望实现领跑。
作为一项新兴技术,虽然目前Iovance Biotherapeutics在TIL疗法领域拔得头筹,但在上海,包括沙砾生物、西比曼生物科技、君赛生物等多家企业已在积极推进相关研究,涉及非小细胞肺癌、消化道肿瘤、妇科肿瘤、血液瘤等多个治疗领域,有望实现多点开花。
TIL疗法具有里程碑意义
细胞治疗对于癌症有突出的治疗效果,因此,该疗法逐渐受到生物制药行业重视。以其中的典型产品CAR-T为例,部分患者只需接受一次性的CAR-T治疗,便能实现长时间治愈。不过,在TIL疗法被获批上市之前,所有的细胞治疗仅在血液瘤领域被证明有效,患者人数更多的实体瘤则久久未能被攻克。
TIL疗法率先实现了突破。从Iovance Biotherapeutics的临床数据来看,接受治疗的患者4年总生存率为22.2%。“不要小看这22.2%,由于接受治疗的患者已处于肿瘤晚期,本身的身体机能就比较差,能取得22.2%的4年总生存率已经非常不容易。”一位行业人士对记者称。吴小华则补充道,在临床治疗上,到治疗末期,许多患者已对药物产生耐药,对于这部分患者来说,TIL疗法的出现给他们提供了新的治疗机会,意义重大。
这一数据验证了TIL疗法在实体瘤领域的治疗潜力,许多生物企业也已纷纷入局。沙利文大中华区生命科学事业部项目经理汪鹏告诉记者,他注意到,在细胞治疗进军实体瘤的过程中,TIL疗法的临床试验管线增加比例最为明显,“2020年至2022年,TIL疗法在整体实体瘤细胞免疫治疗的占比从4.5%增加到17.1%,正在成为探索并治疗实体瘤的一个新治疗趋势。”
上海“TIL军团”整装待发
记者了解到,上海浦东在全国率先布局细胞和基因产业,现已培育产业链上下游企业100多家。截至2023年6月,全国已获批的细胞、基因疗法注册性临床试验项目,浦东占全国的1/4。基于此,浦东的“TIL军团”也已整装待发。
位于浦东的沙砾生物是国内进展最快的企业。记者从企业方面获悉,沙砾生物的在研产品GT101是中国研发进展最快的TIL疗法,目前即将进入关键二期临床试验,预计于2025年底申报上市;下一代在研产品GT201也已正式获得国家药品监督管理局的临床试验默示许可,成为国内首款进入注册临床试验的基因编辑型TIL药物。
另外,西比曼生物科技的实力也不容小觑。公开资料显示,2022年10月,西比曼生物科技的新型TIL疗法C-TIL051的临床试验申请获FDA批准,适应症为PD-1抗体难治或复发的晚期非小细胞肺癌;2023年9月,西比曼生物科技宣布与生物制药公司Nektar开展一项临床研究合作,将评估Nektar的NKTR-255与西比曼的C-TIL051联合用于PD-1抗体治疗后复发或难治的晚期非小细胞肺癌患者的治疗。
吴小华表示,下一步,TIL疗法如何从肿瘤晚期治疗推进到早期治疗、如何拓展适应症、降低成本等方面值得关注。