用考马斯亮蓝法测定植物体内可溶性蛋白质的含量
实验概要
植物体内的可溶性蛋白质大多数是参与各种代谢的酶类,测其含量是了解植物体总代谢的一个重要指标。在研究每一种酶的作用时,常以比活(酶活力单位/mg蛋白)表示酶活力大小及酶制剂纯度。因此,测定植物体内可溶性蛋白质是研究酶活的一个重要项目。常用测定方法有Lowry法和考马斯亮蓝G-250染料结合法。本实验介绍了马斯亮蓝G-250染料结合法。
实验原理
考马斯亮蓝G-250测定蛋白质含量属于染料结合法的一种。考马斯亮蓝G-250在游离态下呈红色,当它与蛋白质的疏水区结合后变为青色,前者最大光吸收在465nm,后者在595nm。在一定蛋白质浓度范围内(0~100μg/ml),蛋白质-色素结合物在595nm波长下的光吸收与蛋白质含量成正比。故可用于蛋白质的定量测定。蛋白质与考马斯亮蓝G-250结合在2min左右的时间内达到平衡,完成反应十分迅速,其结合物在室温下1h内保持稳定。该反应非常灵敏,可测微克级蛋白质含量,所以是一种比较好的蛋白质定量法。
主要试剂
1. 牛血清白蛋白配成1000μg/ml和100μg/ml;
2. 考马斯亮蓝G-250:称取100mg考马斯亮蓝G-250溶于50ml 90%乙醇中,加入85%(W/V)磷酸100ml,最后用蒸馏水定容至1000ml。此溶液在常温下可放置一个月;
3. 90%乙醇;
4. 磷酸(85%,W/V)。
主要设备
1. 分光光度计
2. 10ml量筒1支
3. 研体
4. 10ml容量瓶1支
5. 1ml刻度吸管3支
6. 10ml具塞刻度试管14支
实验材料
植物样品提取液
实验步骤
1. 标准曲线的绘制
1) 0~100μg/ml标准曲线的制作取6支试管,按表1数据配制0~100μg/ml血清白蛋白液各1ml。准确吸取所配各管溶液0.1ml,分别放入10ml具塞试管中,加入5ml考马斯亮蓝G-250试剂,盖塞,反转混合数次,放置2min后,在595nm下比色,绘制标准曲线。
表1 配制0~100μg/ml血清白蛋白液
管号 | 1 | 2 | 3 | 4 | 5 | 6 |
100μg/ml牛血清蛋白量(ml) | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
2) 0~1000μg/ml标准曲线的制作另取6支试管,按表2数据配制0~1000μg/ml牛血清白蛋白溶液各1ml。与步骤1)操作相同,绘出0~1000μg/ml的标准曲线。
表2 配制0~1000μg/ml血清蛋白血液
管号 | 7 | 8 | 9 | 10 | 11 | 12 |
1000μg/ml牛血清白蛋白(ml)
蒸馏水量(ml)
蛋白质含量(mg) | 0 | 0.2 | 0.4 | 0.6 | 0.8 | 1.0 |
2. 样品提取液中蛋白质浓度的测定吸取样品提取液0.1ml(样品提取见各酶活测定),放入具塞刻度试管中(设两个重复管),加入5ml考马斯亮蓝G-250试剂,充分混合,放置2min后在595nm下比色,记录吸光度值,通过标准曲线查得蛋白质含量。
3. 结果计算
样品蛋白质含量(mg/g鲜重)= 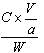
式中C-查标准曲线所得每管蛋白质含量(mg);
V-提取液总体积(ml);
a-测定所取提取液体积(ml);
W-取样量(g)。
附 件 (共1个附件,占23KB)
![]()
未标题-1.jpg
23KB 查看





















