基因编辑进展梳理 Part II 基于CRISPR-Cas9的技术应用篇(三)
上一期为大家介绍了过去一年里CRISPR技术在动物造模及单碱基技术方面取得的重大突破。本期继续为大家从功能基因组筛选、细胞谱系示踪及疾病诊断方面谈谈CRISPR-Cas系统的技术运用。
一、大规模基因功能的筛选
尽管测序和基因组编辑技术取得了重大进展,但是解析复杂的基因型-表型关系仍然是数量遗传学的一个主要障碍。作为强大的基因编辑工具,CRISPR-Cas9系统能够在蛋白编码基因的外显子区域产生移码突变而彻底破坏蛋白表达及功能,这一特性被广泛应用于基因的大规模功能性筛选研究,这也将大大加速评估基因变异的功能影响。
1. 利用CRISPRa构建无偏向性的耐药相关LncRNA筛选平台
2018年4月Cell期刊上刊登一项研究开发了一种开创性的方法来鉴定和确定在急性髓细胞白血病(AML)中lncRNA在化疗药物产生耐药性中所起的功能作用。这一技术通过结合公开可获得的药理学数据库的信息与CRISPR技术,筛选影响治疗反应的编码基因和非编码基因。作为一种全基因组筛查平台,既不偏向于编码基因,也不偏向于非编码基因,能够筛选到新的治疗靶标[1]。

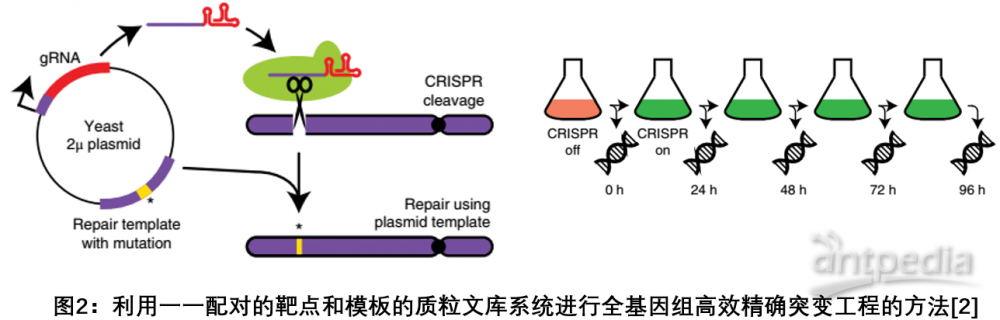
2. 利用一一配对的靶点-模板策略实现全基因组高效精准突变
理解DNA突变体的功能效应对于基础生物学、进化生物学和医学遗传学的研究至关重要;尽管CRISPR-Cas9技术可以实现体内数以千计细胞发生多基因诱导突变的可能,然而高通量测序这些突变体的特异性仍然是技术的瓶颈。2018年4月Nat
Genet期刊刊登了一篇研究,通过改造CRISPR-Cas9系统,解决了目前高通量测序数以万计基因组编辑结果的这一壁垒,开发了一种基于CRISPR的全基因组高效精确突变工程的方法。如图所示,通过构建10000对编码gRNA靶向序列及其相应的顺式修复模板的质粒文库来实现靶点和模板的一一配对,将文库递送到酵母细胞中监测基因突变的影响,突变效率高达95
%。这一策略可以高效精确地追踪大量基因突变对细胞功能的影响,为研究基因的功能提供了强有力的分析工具[2]。
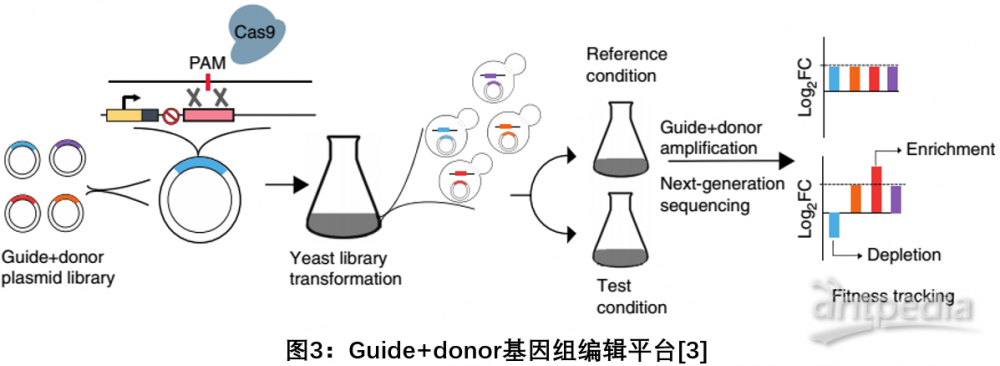
3. Guide+donor:利用CRISPR-Cas9在酵母中高通量构建和功能分析DNA序列变异文库
2018年5月,哈佛基因编辑大牛Church研究组在Nature Biotechnology发文,介绍了一种基于Cas9的方法,在酵母中高效(80-100%)产生特定遗传变异(缺失、替换和插入)的突变体文库,以及整体跟踪其适应性的方法。使用guide+donor方法精确地剔除了酵母基因组中的315个基因,并评估和鉴定了对细胞适应性存活中起重要作用的基因。新的方法不仅能以高通量的方式在酵母菌中精确地进行功能基因组研究,还能深入挖掘低频基因突变及非编码序列的基因功能,为基因功能分析打开了新的大门[3]。
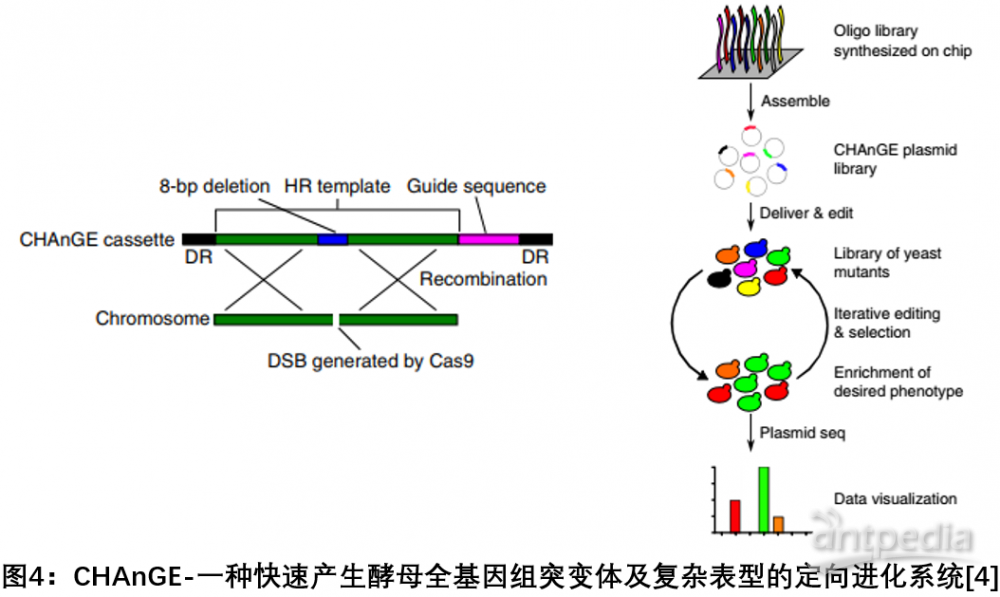
4. CHAnGE:一种基于CRISPR-Cas9和同源定向修复相关的大规模基因组筛选方法
2018年7月,美国伊利诺伊大学赵惠民研究组在Nature Biotechnology发文,开发了一种基于CRISPR - Cas9和同源定向修复相关的大规模基因组筛选方法CHAnGE,可以在全基因组范围快速产生成千上万种精确的酵母单核苷酸突变体,追踪基因突变对细胞的影响,突变效率超过98 %。该研究通过创建全基因组基因突变集合验证了该方法对单核苷酸分辨率基因组编辑的可行性,解决了之前的方法编辑效率局限性的问题。该方法能够对酿酒酵母进行全基因组规模的快速工程化,并进行精确和可追踪的基因突变[4]。
5. MAGESTIC:一种在酵母中可追踪基因组条形码的多重精确基因组编辑技术
2018年7月,美国斯坦福大学的 Steinmetz LM课题组在Nature Biotechnology发文,开发了一种基于Cas9技术利用短的、可追踪的整合性细胞条形码(MAGESTIC)在酿酒酵母中进行多重精确基因组编辑的方法。MAGESTIC使用合成的阵列gRNA-donor的寡核苷酸的质粒系统进行高通量编辑,具有基因组条形码整合的功能,可以防止质粒条形码的丢失,维持稳定的表型。利用LexA - FKH1P融合系统将供体DNA主动招募到DNA断裂部位的方法,可以提高同源重组的效率。并且相比donor融合到Cas9的方式具有更大的优势,一方面可以招募更多拷贝的donor,同时还不依赖于Cas9与DSBs的持续关联。这一技术克服了目前可行方法的几个限制,即质粒条形码的不稳定性,以及在表型分析期间无法区分靶向RNA和供体模板中的Oligo合成和PCR或测序引起的错误。MAGESTIC技术将广泛用于揭示酵母表型的遗传基础[5]。




















