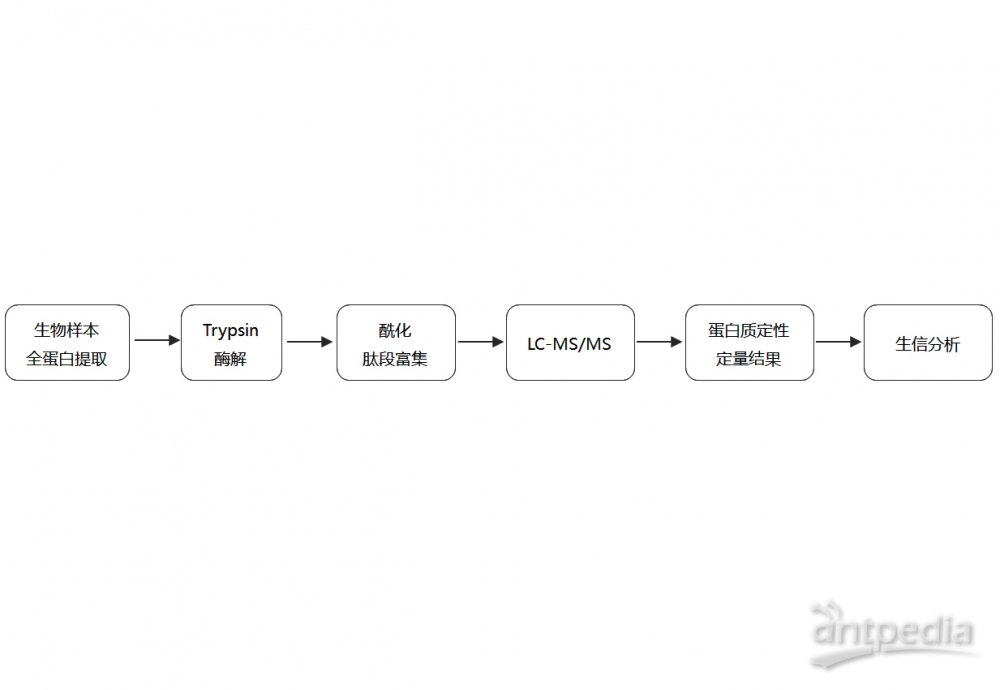
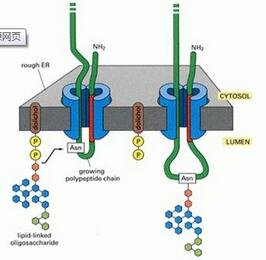
翻译后修饰蛋白质的定性和定量实验(一)
一、引言
蛋 白 质 翻 译 后 修 饰 (P T M ) 在 细 胞 生 物 调 节 中 发 挥 着 基 本 作 用 。 P T M 是 m R N A 翻译 后 蛋 白 质 的 酶 促 共 价 化 学 修 饰 。蛋 白 质 化 学 修 饰 非 常 重 要 ,因 为 它 们 会 潜 在 地 改 变 蛋白 质 的 物 理 或 化 学 性 质 、组 成 、活 性 、细 胞 定 位 或 稳 定 性 。实 际 上 ,在 氨 基 酸 或 蛋 白 质 的 N端 或 C 端 加 入 或 移 除 化 学 基 团 会 导 致 大 部 分 蛋 白 质 发 生 变 化 。一 些 P T M 可 以 被 动 态 地添 加 或 移 除 ,这 是 一 种 可 逆 的 蛋 白 质 功 能 调 控 机 制 。 目 前 超 过 4 0 0 个 特 定 的 蛋 白 质 修 饰已 被 鉴 定 ,也 许 还 有 更 多 的 修 饰 类 型 有 待 发 现 (Creasy and Cottrell, 2004)。迄 今 为 止 最常 见 的 P T M 有 磷 酸 化 、苏 素 化 、泛 素 化 、亚 硝 基 化 、甲 基 化 、乙 酰 化 、硫 酸 化 、糖 基 化 及 酰基 化 (表 40.1)。
D N A 和 组 蛋 白 组 成 了 核 小 体 , 而 核 小 体 捆 绑 在 一 起 组 成 了 染 色 质 丝 (chromatin fiber)。组蛋 白 密 码 (histone code) 假 设 染 色 质 -D N A 的 相 互 作 用 是 通 过 组 蛋 白 上 多 种 P T M 协 同 调 节的 (Jenuwein and Allis,2001; Strahl and Allis,2000)。组 蛋 白 质 上 赖 氣 酸 的 乙 醜 化 最 先 被报 道 ,并 且 与 基 因 转 录 活 性 相 关 (Rothet al. , 2001)。组 蛋 白 尾 部 的 甲 基 化 、乙 酰 化 、A D P -核
糖 基 化 、泛 素 化 和 磷 酸 化 等 修 饰 协 同 调 节 特 定 基 因 的 表 达 程 序 (Godde and U r a , 2008)。
磷 酸 化 修 饰 ,最 普 遍 的 P T M 之 一 ,是 许 多 生 化 学 家 的 研 究 主 题 。 目 前 估 计 3 0 % 的人类 蛋 白 质 都 发 生 了 磷 酸 化 (C o h e n , 2001; H u b bard and Coherul” 3 ) 。例 如 ,胰 岛 素 /胰岛 素 样 生 长 因 子 -K I G F -1) 信 号 通 路 中 ,酪 氨 酸 激 酶 和 磷 酸 酶 将 信 号 从 细 胞 表 面 的 配 体 -结 合 受 体 转 导 至 下 游 耙 标 (Taniguchi et al. ,2006) 。
传 统 的 检 测 蛋 白 质 P T M 的 方 法 包 括 E d m a n 降 解 法 和 薄 层 色 谱 法 (thin-layer chromatography,T L C ) 。 然 而 这 些 方 法 会 有 一 些 限 制 。例如 ,需 要 大 量 起 始 材 料 , 并 且 对 于鉴 定 罕 见 的 或 亚 化 学 计 量 的 P T M 无 能 为 力 。 由 于 大 多 数 P T M 都 会 导 致 与 之 对 应 的 被修 饰 蛋 白 质 的 质 量 改 变 , 因 此 ,能 够 检 测 蛋 白 质 分 子 质 量 改 变 的 方 法 ,即 基 于 质 谱 的 蛋 白质 组 学 ,目 前 已 普 遍 用 于 鉴 定 P T M 。一 些 P T M ,如 磷 酸 化 和 甲 基 化 , 会 增 加 蛋 白 质 的 质量 ,然 而 另 外 一 些 P T M ,像 信 号 肽 的 去 除 或 二 硫 键 形 成 ,则 使 蛋 白 质 的 质 量 减 少 。依 赖 于所 使 用 的 质 谱 设 备 , 本 章 所 介 绍 的 蛋 白 质 组 学 方 法 具 有 髙 灵 敏 度 优 势 ,能 够 以 小 于 百 万 分
之 一(< 1 p p m ,part per million) 的 精 确 度 测 量 分 子 质 量(M a k arov et al. , 2006; L u etal. ,2008 ; Scigelova and M a k a r o v , 2006)。设 备 制 造 商 和 理 论 研 究 者 一 直 致 力 于 提 升 仪器 技 术 以 及 发 展 新 的 P T M 鉴 定 方 法(Garcia et al. ,2005; 2007),如 近 期 这 一 领 域 内 的研 究 进 展 包 括 ,断 裂 肽 段(fragmentation of peptide) 的 电 子 转 移 解 离 法(electron transfer
dissociation,E T D ) 和 能 够 精 确 测 量 未 消 化 蛋 白 质 质 量 的 动 态 检 测 器(C o o n et al. , 2004;Mikesh et al. ,2006; Pitteri et al. ,2005; Syka et al. ,2004)。
能 够 选 择 性 分 离 可 能 发 生 P T M 的 蛋 白 质 或 多 肽 的 富 集 方 法 可 以 与 基 于 质 谱 的 蛋 白质 组 学 方 法 联 用 。这 些 富 集 手 段 可 以 减 少 罕 见 修 饰 所 带 来 的 问 题 。可 将 众 多 可 用 的 亲 和富 集 策 略 主 要 分 为 两 类 : 第 一 类 是 用 抗 体 识 别 一 个 特 定 P T M 或 者 带 有 特 定 修 饰 的 肽 段 ,如 抗 磷 酸 化 酪 氨 酸 的 抗 体 可 用 于 富 集 含 有 磷 酸 化 酪 氨 酸 残 基 的 肽 段(Blag0ev et al. ,2004 ; R u s h e t a L ,2005 !Zhang etal. ,2005); 第 二 类 方 法 基 于 固 定 化 树 脂 对 某 种 修 饰 的化 学 亲 和 作 用 ,包 括 针 对 磷 酸 化 的 固 定 化 金 属 亲 和 色 谱 法(I M A C ) 和 针 对 糖 基 化 的 凝 集素 色 谱 法 (Ito et al. ,2 0 0 9 ) ,这 些 方 法 已 经 广 泛 使 用 并 仍 在 发 展 之 中 。
另外 一 个 能 够 有 效 鉴 定 P T M 并应用普遍的蛋白质组学方法是二 维 凝 胶电泳(twodimensional gel electrophoresis,2I> GE)。 P T M 能够改变蛋白质的等电点及其在 2D 凝胶中的电泳迁移率。如果通过 2D 凝胶电泳发现了不同细胞种类或生长条件之间的这种改 变 ,就可以将该蛋白质分离出来,并通过测序鉴定它的 P T M 。例如, 一个蛋白质不同的磷酸化将改变它的等电点,并且可能会导致电荷异质性。这种发生不同磷酸化的蛋白质会表现为一串具有不同的等电点但是相似的分子质量的2D 斑点。这种形式有时被形象的比喻为「项链上的一串珍珠」。多年来已经发明了许多揭示蛋白质P T M 的特定蛋白质染色方法 (Ge et al. ,20〇4 ; Patton, 2002),包括直接检测胶中磷蛋白和糖蛋白的荧光方法(G e et al. , 2004; Steinberg et al. ,2001; Schulenberg et al. ,2003a ,b , 2004)。 对于这 些 2D 斑 点 ,蛋 白 质 可 被 胶 内 消 化 ,然 后 回 收 的 肽 段 通 过 质 谱 分 析 ,以 鉴 定 、验 证 并 绘 制可 能 的 P T M 图 谱(H a y d u k et al. ,2004; Steinberg et aL , 2003)。然 而 用 2D 凝 胶 电 泳法 鉴 定 P T M 并 非 易 事 ,因 为 修 饰 肽 段 的 回 收 和 分 析 常 常 会 出 现 很 多 问 题 。
蛋 白 质 组 学 已 有 多 种 工 具 来 量 化 蛋 白 质 及 其 特 定 P T M 的 绝 对 丰 度 或 中 度 相 对 丰 度(Paoletti and W a s h b u r n , 2006)。 目 前 已 经 发 展 多 种 体 内 和 体 外 标 记 方 法 ,可 利 用 质 谱定 量 P T M ,并 精 确 测 量 细 胞 事 件 中 P T M 的 变 化(Goodlett et al. , 2001; Gygi et al. ,1999; O d a et al. ,1999; O n g et al. , 2002; Ross et al. , 2004; Zhang et al. ,2005)。P T M 的 定 量 对 于 研 究 某 一 特 定 P T M 的 生 物 学 意 义 有 着 至 关 重 要 的 作 用 ,这 是 因 为 简 单的 鉴 定 一 个 修 饰 的 存 在 与 否 ,有 时 并 不 足 以 提 供 足 够 的 生 物 学 信 息 来 说 明 它 的 重 要 性 。Matthies M a n n 及 其 同 事 的 一 项 研 究 发 现 ,H e L a 细 胞 中 1 4 % 已 鉴 定 的 磷 酸 化 位 点 , 在表皮
生 长 因 子 的 刺 激 下 增 加 了 至 少 2 倍, 这说明了 P T M 定 量 的 重 要 性 (Olsen et al. ,2006)。
然而,在使用基于质谱的蛋白质组学来鉴定 P T M 时, 需考虑到某些局限性。某些P T M ,如丝氨酸、酪氨酸、苏氨酸的磷酸化,以 及 O-糖基化或] V-糖基化是不稳定的,因此在样品制备过程中维持这些修饰比较困难。而且如果没有采用有效的分离方法, 未修饰肽段或蛋白质会影响质谱分析。当样品中大部分蛋白质分子都未被修饰时,P T M 亚化学计量的检测将会异常艰难。对于质谱分析,有不同厂家的众多仪器可供选择,它们均有各自的优点和缺陷。通常的方法是将蛋白质消化为肽段,进而直接分析肽段。一个给定肽段的修饰将会降低离子化效率,从而会影响质量谱图,并阻碍序列鉴定。另 外 ,由于许多肽段包含众多潜在P T M 的氨基酸修饰位点,因此有时很难判断到底是哪一个氨基酸发生了修饰。除此之外,当使用碰撞诱导解离(collision induced dissociation,CID) 来断裂含不 稳 定 PTM (如磷酸化和糖基化) 的肽段时,不稳定的基团将会发生消除反应,从而产生中性丢失碎片(neutral loss fragment)。 这个反应在能量上比酰胺键断裂更有利。如此产生的质量谱图通常不能得到足够的测序离子,因而无法准确鉴定肽段或者被修饰的氨基酸。最后,稀 有 P T M 的检测非常有挑战性, 它的鉴定通常需要非常高灵敏度的质谱手段或者 P T M 富集策略。
对于使用任何一种质谱方法得到的蛋白质组学数据, 需要格外关注所获得信息的丰度和复杂程度。典型的,在液相色谱和串联质谱联用分析消化蛋白质的异质混合物时,能够产生成百上千万的谱图。在所获得的质谱图中,对于观测到的峰有近乎无穷的 P T M和相应加合肽的可能组合。大量的数据需要一种「 in silico」蛋白质数据库检索算法,从而将基因组数据库得到的理论谱与实验所得到的观测谱相匹配。搜索实验谱鉴定 P T M时需要了解一些潜在修饰特性的「先验」知识,这是因为搜索时由于计算资源有限而限制了可以纳人考虑的修饰数量。例如,当仅考虑丝氨酸(S )、苏氨酸(T )、酪氨酸(Y ) 的磷酸化时(这种磷酸化增加80 D a 标称质量),所需的计算资源,比起搜索同样的数据集但是没有质量漂移的情况要高出指数数量级。这种情况的发生是由于算法不仅需要考虑没有任何修饰的肽段,还不得不考虑当蛋白质序列中S 、T 、Y 残基发生修饰或未发生修饰的所有情况。为解决这个问题,许多团队一直致力于发展算法软件,用来从质谱数据中鉴定未能预料的 P T M ( C h a l k l e y et al. ,2008; H a n s e n et al.,2001,2005; T a n g et al. , 2005)。这些算法可以计算推测的肽段序列和实验M S /M S 前体间的质量差异,并将质量漂移定位到肽段的序列位置(Hansen et al. ,2005)。
本章主要针对研究最频繁的一些修饰,着重介绍质谱和蛋白质组学领域的现存和新出现的鉴定P T M 的技术方法,但这些方法的应用并不仅限于本章所介绍的内容。我们也会与讨论修饰类型一样,对于串联质谱法中可用的技术做一概述,这些技术会影响实验者鉴定特定P T M 的能力。前期对于 P T M 的整体分析研究凸显了各种各样的困难—这些困难来自于从大规模筛选所得到的大批数据中分辨可用信息。本章会给出一个工作流程示例,来帮助研究者发展最适用于研究他们当前关心的问题和可用资源的方法。除此之外,我们将概述许多可用方法来进一步定量PT M 。很 明显,可供研究者选择的资源和技术越来越多,这些资源和技术中很多都不仅仅可用来鉴定P T M 。