毕赤酵母表达(pichia pastoris expression )实验手册(5)
3.5 Pichia酵母表达直接PCR鉴定重组子的方法
3.5.1 模板的处理:
1. 平板上的菌落长到肉眼可见时(约12小时);
2. 将除了模板之外的其它PCR反应液的组分准备好,并分装。引物最好使用Kit中已有的检测专用的引物,或者或者一条使用载体上的引物,一条使用基因的特异性引物(这样做可以鉴定非定向克隆的方向);
3. 用半根灭菌的牙签(节约,而且好用)挑取菌落,在PCR管中涮以下,放入一个灭菌的1.5毫升离心管,对PCR管和1.5毫升离心管编号;
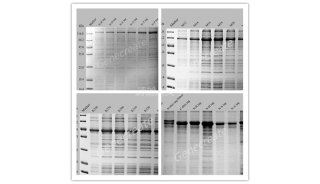
4. PCR扩增,1% agarose电泳;
5. 对于PCR扩增显现特异性条带的克隆,把置于1.5毫升离心管中的半截牙签扔到5毫升YPDZ培养基中,30度培养,8-12小时后提质粒,酶切鉴定确认。
注意:本试验方法应用在需要挑取的克隆较多(也就是克隆效率低),使用PCR初筛可以使工作量大为降低。
3.5.2 PCR反应体系:
以TaKaRa Taq DNA聚合酶反应为例:
3.5.3 PCR反应条件:
3.6 毕赤酵母基因组提取方法
⑴ 接种重组和空质粒转化子于5ml YPDZ培养基, GS115菌于YPD培养基作对照,30℃,培养16~18小时。
⑵ 室温下,1500 g离心5-10min收集菌体
⑶ 100 ulTE(pH 7.0)重悬,加入300 ul EDTA(pH 8.0),0.07M Tris-HCl,3 ulβ-巯基乙醇,1ul Lyticase ,37℃水浴30 min。
⑷ 10000g离心5~10min,取沉淀,加90ul TE重悬。
⑸ 200ul 饱和酚,200ul氯仿,混匀,离心30s ,取上层水相。
⑹ 加入两倍体积无水乙醇以及1/10体积的NaAC,-20℃放置30min;
⑺ 10000g离心20min,弃上清;75%乙醇漂洗沉淀一次;
⑻ 干燥后,加入15 μl的TE或H2O溶解,-20℃备用。
3.7 Mut+表型重组酵母的诱导表达实验
1. 挑选一单菌落,置于装有25ml MGY、BMG或BMGY培养基的250ml摇瓶中,于28-30°C/250-300 rpm培养至OD600 = 2-6 (~16-18 h);
2. 室温下1500~3000g离心5min,收集菌体,用MM、BMM或 BMMY重悬菌体,使OD600 =1.0左右(约100~200ml);
3. 将步骤2所得的菌液置于1L的摇瓶中,用双层纱布或粗棉布封口,放置于28-30°C/250-300 rpm的摇床上继续生长;
4. 每24h向培养基中添加100% 甲醇至终浓度为0.5~1.0%;
5. 按时间点分别取菌液样品,取样量为1ml,置于1.5ml EP管中,最大转速离心2~3min,分别收集上清和菌体,分析目的蛋白的表达量和菌液最佳收获时间。时间点一般取:0、6、12、24、36、48、 60、72、84和96h;
6. 对分泌表达,分离样品的上清液;对胞内表达,分离样品的菌体沉淀,带检测样品用液氮或干冰速冻后,于-80°C保存备用;
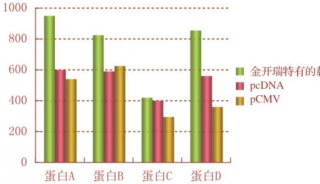
7. 可以用SDS-PAGE、Western-Blot及活性实验检测与鉴定重组蛋白的表达。
3.7 Muts表型重组酵母的诱导表达实验
1. 挑选一单菌落,置于装有25ml MGY、BMG或BMGY培养基的250ml摇瓶中,于28-30°C/250-300 rpm培养至OD600 = 2-6 (~16-18 h);
2. 室温下1500~3000g离心5min,收集菌体,用1/5到1/10原培养体积的MM、BMM或 BMMY重悬菌体(约10~20ml);
3. 将步骤2所得的菌液置于100ml的摇瓶中,用双层纱布或粗棉布封口,放置于28-30°C/250-300 rpm的摇床上继续生长;
4. 每24h向培养基中添加100% 甲醇至终浓度为0.5~1.0%;
5. 按时间点分别取菌液样品,取样量为1ml,置于1.5ml EP管中,最大转速离心2~3min,分别收集上清和菌体,分析目的蛋白的表达量和菌液最佳收获时间。时间点一般取:0、24、48、72、96和 120h;
6. 对分泌表达,分离样品的上清液;对胞内表达,分离样品的菌体沉淀,带检测样品用液氮或干冰速冻后,于-80°C保存备用;
7. 可以用SDS-PAGE、Western-Blot及活性实验检测与鉴定重组蛋白的表达。
4. 试验的注意事项
4.1信号肽识别位点的设计
以质粒pPICZαA为例。在利用PCR反应在外源基因两端引入酶切位点的试验中。如果质粒pPICZαA双酶切中丢失了KEX2蛋白酶的酶切位点Lys-Arg,应该在上游中,增加了编码Lys、Arg的密码子AAA、AGA
。酵母细胞膜中中的KEX2蛋白酶是α-factor信号肽的切割酶,它能有效识别酶切位点Lys-Arg,通过对信号肽的切割使基因表达产物释放至胞外。
4.2 PCR产物酶切保护碱基的设计
利用PCR转换酶切位点,通过P3、P4两引物的扩增在rhEGF的两端加上XhoⅠ、Xba Ⅰ的识别位点和5个保护碱基。
根据限制性核酸内切酶的工作原理,内切酶首先需要结合到核苷酸序列上,并在上面进行滑行,直至识别到酶切位点,为了能使内切酶有效的结合到序列上以利于其的有效加工。在利用PCR进行酶切位点转换的时候,通常应在5'端限制酶位点外再加3个保护碱基GC[16],防止引物合成中因为合成效率和纯化问题而导致的酶切位点的残缺。
核苷酸保护碱基之为了保证限制型内切酶的工作效率,在其识别位点的两侧应该保证一定的旁侧序列,换言之,识别位点是限制型内切酶识别并特异性切割底物的必要而不充分的条件。鉴于NEB(New
England
Biolabs)公司在限制酶领域的总体研究水平和对保护碱基方面的独到理解,在设计引物时可以参照NEB公司的产品目录后面的附录:Cleavage
to the end of DNA
fragments进行[17],但是,一些不常用的酶或虽有推荐的保护碱基序列但酶切效率仍不高的酶还是很难设计保护碱基。本次实验中,根据美国基因动力实验室文献的报道[18];XbaI、NheI和SpeI位点5’端保护碱基须在5个左右才容易被酶切割,以及一些前人的经验总结,我们在设计引物时在识别位点5’端,设计了5个保护碱基。以保证较高的酶切效率。
4.3高保真DNA聚合酶的使用
Vent DNA聚合酶是从高温嗜热菌中分高出的高保真(High Fidelity)耐高温 DNA聚合酶,能纠正
DNA扩增中产生的错误,而传统的Taq DNA聚合酶,Tth DNA聚合酶及其变体
AmpliTaq,KlenTaq等都无3’至5’纠错功能,因此在扩增时出现碱基错配的机率为
2.1x104。这对于大批量的PCR产物而言,并不是十分严重的问题,因为又同样错误的DNA分子仅占全部合成的DNA分子群体的极少一部分。但是,如果PCR扩增的DNA片段是用于分子克隆,那么这就是件值得重视的事情,因为此种分子含有一个或数个错误掺入的核苷酸,那么在该克隆中的所有克隆DNA都将带有同样的“突变”。将会导致严重的后果[19]。
具有校正功能的 DNA聚合酶还有Pfu,Deep Vent,Pwo,UlTma等,Pfu是其中出错率最低的,比Taq DNA聚合酶低10倍。在本论文中,为了减少hEGF 在 PCR过程的错误扩增,在人工合成hEGF的过程中使用了Vent DNA聚合酶。