蛋白质组学的样品制备
想要研究蛋白质,首先要得到高度纯化且具有生物活性的目的物质,因此,蛋白样品的制备是重要前提。蛋白提取的质量和效果对后续的研究分析有重要影响。不同种类的样本在制备过程中,存在一些差异,要根据样本特征调整实验方案和操作细节。
基本原则
样品处理尽量简单,减少蛋白损失;
尽量避免蛋白的降解;
尽可能提高样品蛋白的溶解度;
防止溶液介质中对蛋白质的人为修饰;
去除非蛋白杂质。
制备过程
蛋白质的制备一般要经过以下四个阶段:选择材料和预处理,材料的破碎,提取和纯化,浓缩、干燥和保存。由于蛋白种类繁多,性质差异较大,因此不可能有一个固定的程序适用各类蛋白质的分离。根据性质进行分类,大部分蛋白质均可溶于水、稀盐、稀酸或稀碱溶液中,少数与脂类结合的蛋白质溶于乙醇、丙酮及丁醇等有机溶剂中。因此可采用不同溶剂提取、分离及纯化蛋白质。
制备原理
蛋白质在不同溶剂中溶解度的差异,主要取决于蛋白分子中非极性疏水基团与极性亲水基团的比例,其次取决于这些基团的排列和偶极矩。故分子结构性质是不同蛋白质溶解差异的内因。温度、 pH、离子强度等是影响蛋白质溶解度的外界条件。①温度:多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。②pH:蛋白质,酶是具有等电点的两性电解质,提取液的 pH值应选择在偏离等电点两侧的 pH 范围内。用稀酸或稀碱提取时,应防止过酸或过碱而引起蛋白质可解离基团发生变化,从而导致蛋白质构象的不可逆变化,一般来说,碱性蛋白质用偏酸性的提取液提取,而酸性蛋白质用偏碱性的提取液。③离子强度:稀浓度可促进蛋白质的溶,称为盐溶作用。同时稀盐溶液因盐离子与蛋白质部分结合,具有保护蛋白质不易变性的优点,因此在提取液中加入少量 NaCl 等中性盐,一般以 0.15 摩尔。升浓度为宜。缓冲液常采用 0.02-0.05M 磷酸盐和碳酸盐等渗盐溶液。提取蛋白质时常根据这些内外因素综合加以利用,将细胞内蛋白质提取出来,并与其它不需要的物质分开。
制备方法
破碎的方法有许多种,可归纳为:机械法(超声波法、机械匀浆法、液氮研磨法和玻璃珠破碎法),化学法(去污剂法、酶裂解法、),物理法(循环冻融法、渗透法、高压法)。这些方法有不同的应用范围,基本的原则都是要以最小的限度减少蛋白水解和其它形式的蛋白降解变性,这也就是在样品制备破碎这一步的关键所在。而常用的方法有:超声波法、机械匀浆法、液氮研磨法、盐析、沉淀法。其中,有机溶剂沉淀法使用较为普遍,常用的有机溶剂有丙酮、苯酚等。
Table 1 有机溶剂沉淀法相&其他沉淀法
| 优点 | 1.分辨能力高,即一种蛋白质或其他溶质只有在一个比较窄的有机溶剂浓度范围内沉淀。 2.根据实验要求选择最合适的溶剂可以使实验尽可能准确。 3.成本较低。 |
| 缺点 | 容易引起蛋白质变性失活,操作常需在低温下进行。且有机溶剂易燃、易爆、安全要求较高。 |
冷丙酮沉淀丙酮和苯酚沉淀法注意事项:
1.冷丙酮沉淀的时间与温度。
常温或升温时,蛋白立体结构展开,丙酮极容易与其中的色氨酸、酪氨酸等氨基酸进行疏水结舍导致蛋白变性,所以我们通常预冷丙酮并且低温操作。
2.超声功率和时间,重在观察超声后样品溶性的均匀度。
3.一般和三氯乙酸一起使用,效果更好。
4.还原烷基化。
苯酚提取
1.各种试剂的正确及精确配制。(如:煎糖提取液)
2.加入饱和酚后要充分震荡和离心。(使蛋白充分与酚、色素H键结合,让其分三层)
3.需纯化蛋白。(甲醇、TCA/冷丙酮去色素、苯酚等杂质)
Table 2 冷丙酮沉淀&苯酚提取
| 提取方法 | 优点 | 缺点 |
| 冷丙酮提取 | 操作简单,适合一般蛋白的提取 | 容易使蛋白变性,杂质较多的蛋白提取效果较差 |
| 苯酚的提取 | 适合杂质较多的蛋白样本,需求样本量少 | 操作过程较繁琐,耗时长 |
植物组织含有较厚的细胞壁,给组织中蛋白质的提取增加了一定的难度。植物材料必须经过去壳,脱脂并注意植物品种和生长发育状况不同,其中所含生物大分子的量变化很大,另外与季节性关系密切。目前常用的植物蛋白的提取方法有两种:一种是普通 Tris-HCl 提取法,该方法通过选择适当的提取缓冲液pH,将植物中的可溶性蛋白尽可能地溶解;另一种是 TCA/丙酮沉淀法,该方法中 TCA作为蛋白质变性剂,能有效抑制丝氨酸蛋白酶和巯基蛋白酶的活性,减少蛋白损失,因此得到较为广泛的使用。但这两种方法都不能有效地去除产物中的非蛋白物质,会对后续的研究产生不利的影响。而酚/SDS蛋白提取法中,利用酚在SDS这种阴离子型表面活性剂的存在条件下能充分溶解蛋白的特点,可以取得在较短的时间内充分溶解植物组织中蛋白的效果,得到的蛋白纯度更高。色素较多的植物样本,为了不影响后续的分离纯化,可以在裂解液中加入适量PVP(一般是材料鲜重的10%)。
植物样本
实例:PPR蛋白的提取
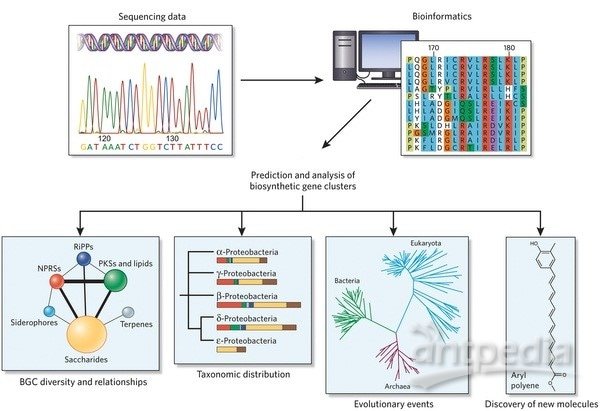
PPR(Pentatricopeptide repeat proteins):主要存在于植物叶绿体和线粒体中,主要参与RNA编辑,与植物生长、发育和繁殖有关,以及对ABA和非生物胁迫的响应。PPR蛋白[2]具有降解率异常高,易聚合特性和高pI的特性,某些PPR蛋白具有ATP依赖。在提取PPR蛋白的过程中,蛋白酶和磷酸酶抑制剂的使用是保持蛋白非变性状态最关键因素。ATP-辅因子的使用大大降低了PPR蛋白的降解。降低离心时间避免PPR沉淀,还需要添加一个还原剂,维持适宜pH。
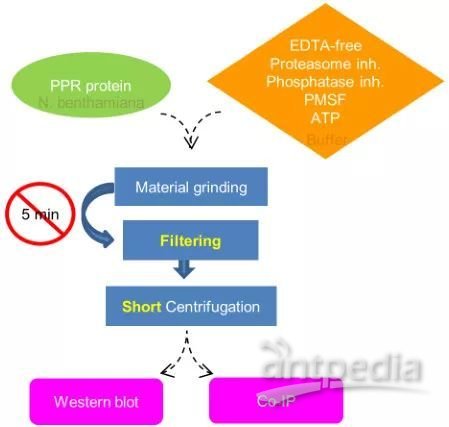
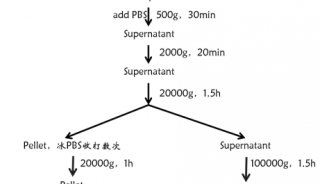
Fig 1. PPR蛋白的提取[1]
非变性蛋白提取缓冲液(不含EDTA):[50 μM MG132蛋白酶体抑制剂;1x磷酸酶,防止被26S蛋白酶体讲解;5 mM ATP;1 mM PMSF;1 mM DTT或 0.04 mM β-巯基乙醇]。研磨;40 Μm尼龙膜过滤;12,000 rpm,4℃离心1min,去细胞碎片; 2x 样品缓冲液:[Tris-HCl 250 mM,pH 6.8;甘油20% (v/v);SDS 4% (p/v);β-巯基乙醇10% (v/v);溴酚蓝0.025% (p/v)],65℃孵育5 min后上样。
动物样本
动物材料中的蛋白质有些以可溶性的形式存在于体液 (如血浆、消化液等)中,可以不必经过提取直接进行分离。蛋白质中的角蛋白、胶原及丝蛋白等不溶性蛋白质,只需要适当的溶剂洗去可溶性的伴随物,如脂类、糖类以及其他可溶性蛋白质,最后剩下的就是不溶性蛋白质。蛋白质经细胞破碎后,用水、稀盐酸及缓冲液等适当溶剂,将蛋白质溶解出来,再用离心法除去不溶物,即得粗提取液。对动物组织,必须选择有效成份含量丰富的脏器组织为原材料,先进行绞碎、脱脂等处理。
实例:肌肉组织蛋白的提取
有研究,对肌肉组织做了基于NMR检测的提取条件的一些比较,发现提取溶剂以甲醇/氯仿/水(v/v/v, 2/2/1.8)为最佳,与组织的比例为30 mL/g。另外作者还用了三种不同方法来破碎样本,分别是研磨并冻干的样本粉末、研磨过的湿组织样本和电子组织匀浆器(5 mL/g的提取溶剂比例)处理过的湿组织样本,发现冻干粉样本的谱图基线明显比另两种方法处理的要更平一些,而且样本间的差异最小,匀浆法次之。冻干粉样本的制备方法为:
i. 离体组织在液氮条件下速冻,并且于-80 ℃下保存;
ii. 液氮条件下研磨;
iii. 冷冻干燥得到冻干粉;
iv. 以30 mL/g的比例加入提取溶剂甲醇/氯仿/水(v/v/v, 2/2/1.8)。
v. 将样品涡旋3次,每次15 s,中间停顿的时间应将样本放在碎冰上使之维持低温态。
vi. 在4 ℃、10000 g的条件下离心10 min,去除上清液,即得代谢物的提取溶液。
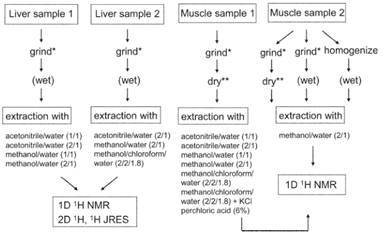
Fig 2. 组织蛋白提取[3]
由于处理得到冻干粉样本一般都要耗费较长时间,为了兼顾较高的提取效率、良好的重现性以及操作的简便和快速,因此可以考虑使用匀浆法来制备组织样本,并使用甲醇/氯仿/水(v/v/v, 2/2/1.8)作为提取溶剂。
微生物样本
微生物具有细胞壁结构,因此需要破壁处理。另外,应注意它的生长期,在微生物的对数生长期,酶和核酸的含量较高,可以获得高产量,以微生物为材料时有两种情况:
(1)得用微生物菌体分泌到培养基中的代谢产物和胞外酶等;
(2)利用菌体含有的生化物质,如蛋白质、核酸和胞内酶等。
常用裂解液:50 mM Tris-HCl(pH 8.5-9.0),2 mM EDTA,100 mM NaCl,0.5% Triton X-100;用前加入100 μg/mL溶菌酶,1μL/mL的蛋白酶抑制剂PMSF。该裂解液用量为10-50mL裂解液/1g湿菌体。
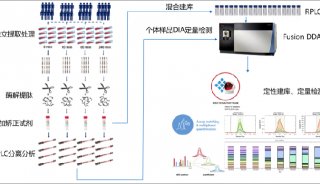
实例:人体肠道菌群蛋白的提取
宏蛋白质组学研究是肠道菌群功能特征的有力研究方法,然而,蛋白质的产量和质量,以及微生物中不同细菌的相对数量对组学分析有直接影响。目前各种蛋白提取方法缺乏一致性,需要针对不同蛋白、不同研究目的来制定特异性的提取方案。研究发现,从革兰氏阳性的厚壁菌和放线菌中提取出总的蛋白质,需要细胞的机械破碎;使用超声波破碎法和SDS裂解的蛋白质提取方法有很好的效果。
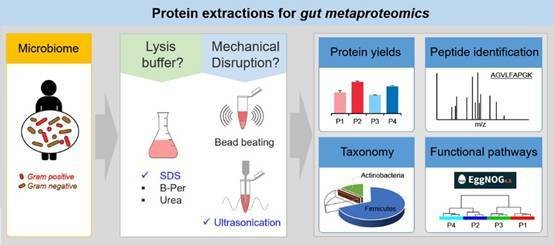
Fig 3. 肠道菌群蛋白提取[4]
现在市场上有针对不同样本,不同蛋白的抽提试剂盒,可直接购买按照说明书操作使用。如果为了降低成本,也可以自己配制,只要不怕麻烦,搜索文献,摸索条件,总能找到经济有效的制备方案。
以下常用试剂要根据样本种类和目的蛋白特性来选择,一般裂解液产品中都含有这些成分,但因离子种类、pH和浓度等因素的差异具有不同效果。
离液剂:尿素和硫脲等;
表面活性剂:SDS、胆酸钠、CHAPS等;
还原剂:DTT、β-巯基乙醇、DTE、TBP、Tris-base 等;
蛋白酶抑制剂及核酸酶:EDTA、PMSF、蛋白酶抑制剂混合物等
注意事项
1.在蛋白质制备过程中使组织始终置于冰上,离心机、离心管等仪器设备要提前预冷,以防蛋白质的降解。
2. 要加入适量的裂解液,裂解一定要充分,均匀。
3. 植物和动物组织样本一般采用研磨或匀浆机破碎处理,细胞和菌体样本一般采用超声破碎,破碎过程中要避免材料的融化。
4. 对预处理好的材料,若不立即进行实验,应冷冻保存(-80℃),对于易分解的生物大分子应选用新鲜材料制备。
5. 对于样本量需求少的研究,且组织样品本身非常细小,可直接裂解,减少蛋白损失。
参考文献
[1] Andrés-Colás N, Van D S D. Optimization of non-denaturing protein extraction conditions for plant PPR proteins[J]. Plos One, 2017, 12(11):e0187753.
https://doi.org/10.1371/journal.pone.0187753
[2] Ping Yin, Quanxiu Li, Chuangye Yan, et al. Structural basis for the modular recognition of single-stranded RNA by PPR proteins[J]. Nature 2013(504): 168–171.
https://doi.org/10.1038/nature12651
[3] Lin C Y, Wu H, Tjeerdema R S, et al. Evaluation of metabolite extraction strategies from tissue samples using NMR metabolomics[J]. Metabolomics, 2007, 3(1):55-67.
10.1007/s11306-006-0043-1
[4] Xu Z, Li L, Mayne J, et al. Assessing the impact of protein extraction methods for human gut metaproteomics[J]. Journal of Proteomics, 2017.
https://doi.org/10.1016/j.jprot.2017.07.001