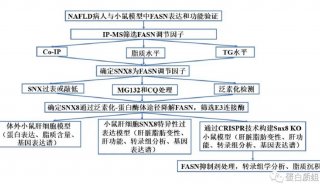
纳米微粒(NPs)在治疗性乙肝疫苗开发与揭示免疫学新...
纳米微粒(NPs)在治疗性乙肝疫苗开发与揭示免疫学新机制的应用
乙型肝炎病毒(HBV)感染是世界范围内最常见的慢性病毒感染,与肝硬化及肝癌的关系密切,是全球性重大公共卫生健康问题之一。尽管开发了针对HBV的预防性疫苗,但是诱导有效抗体应答的治疗性免疫仍然存在困难。
纳米微粒(NPs)可以作为各种类型物质的保护性递送载体,增加物质的稳定性和溶解性,延长半衰期,同时纳米微粒还可以靶向癌细胞免疫系统,识别纳米和微米大小的颗粒(比如病毒和细菌),并对它们做出反应。在材料科学与生命科学飞速发展的今天,纳米材料应用于疫苗的开发,癌症的治疗等方面有着广阔的前景。
HBV表面蛋白preS1结构域是肝细胞上主要的病毒附着位点,为抗病毒治疗提供了靶点,但是,其免疫原性差限制了临床转化。近期,中国科学院生物物理研究所感染与免疫重点实验室朱明昭课题组在Nature Nanotechnology(IF:33.407)上发表了题为“Dual-targeting nanoparticle vaccine elicits a therapeutic antibody response against chronic hepatitis B”的文章,报道了一种效果显著、具有临床转化潜力的治疗性乙肝疫苗,而且揭示了纳米颗粒抗原靶向递送、转运、诱导Tfh和B细胞活化应答的免疫学新机制,具有重要的免疫学理论价值和医学应用前景。
常规的乙型肝炎表面抗原(HBsAg)疫苗在大多数健康的接种人群中诱导产生保护性抗体,并有效降低了新的HBV感染的发生率。但是,HBsAg在慢性乙型肝炎(CHB)临床前动物模型或患者中均无法诱导有效的抗体应答,这可能是由于病毒抗原长期诱导的抗原特异性免疫耐受。因此,迫切需要一种有效根除乙肝的治疗策略。与HBsAg相比,HBV表面抗原的preS1结构域被认为是开发治疗性疫苗的理想免疫原候选物。在CHB患者中,对preS1似乎比对HBsAg的免疫耐受性低得多。实际上,作者的研究显示,preS1疫苗(而不是HBsAg疫苗)接种可以诱导携带HBV的小鼠产生中和性抗体。但是,与HBsAg相比,preS1似乎不是有效的抗体诱导剂。因此,如何提高preS1的免疫原性以增强治疗性抗体反应是当前基于preS1开发治疗性疫苗的关键问题。
淋巴结(LN)抗原呈递细胞(APC)靶向治疗已被普遍认为是许多纳米疫苗的重要特征。然而,考虑到APC的复杂组成和不同APC亚型的多样化功能,纳米疫苗免疫过程中不同APC亚型的特定作用以及如何协调靶向它们以进行有效的适应性免疫反应尚不清楚。铁蛋白自组装NPs最近在疫苗设计中得到了广泛的认可。但是,其潜在的免疫学机制仍未完全阐明。在该研究中,实验团队设计了铁蛋白NP-preS1疫苗。
●评估疫苗的免疫原性和生物安全性 ●
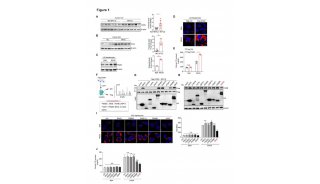
首先,他们对这种疫苗的免疫原性及安全性进行了评估。结果发现,第21天,铁蛋白NP-preS1疫苗诱导的抗体水平是可溶性SC-preS1的50倍。铁蛋白NP-preS1免疫组中的抗preS1水平增加,并在第60天达到峰值,此时测得的抗体水平约是SC-preS1对照疫苗组的150倍,此时抗体水平仍然保持低位。抗体反应逐渐下降,但在第235天仍可检测到。此外,与SC-preS1对照组相比,加强免疫在铁蛋白NP-preS1组中引起了更强的抗体反应(约600倍)。此外,将preS1抗原与铁蛋白NP物理混合而不是共价结合不能引起强烈的抗preS1反应,这表明在铁蛋白NP上展示抗原的必要性。因此,与铁蛋白NPs结合的preS1通常增强preS1抗原的免疫原性并引发有效的抗体反应。进一步的研究表明,铁蛋白NP-preS1疫苗诱导的抗preS1抗体比SC-preS1诱导的抗体具有更高的亲和力。从安全性的角度来看,尽管很容易诱导抗激烈热球菌(Pf)—铁蛋白的强烈反应,但在免疫Pf铁蛋白NP-preS1后没有诱导出针对小鼠铁蛋白的交叉反应抗体。另外,谷氨酸丙酮酸转氨酶和谷氨酰草酰乙酸转氨酶的血清水平都正常。铁蛋白NPs的最低铁含量不太可能影响体内铁的稳态。综上所述,基于铁蛋白-NP的preS1疫苗具有显著的免疫原性和生物安全性。

图1. 铁蛋白NP疫苗的分子设计及其诱导的抗体反应
●评估疫苗的预防和治疗作用●
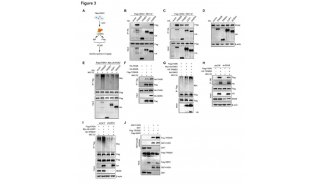
为测试铁蛋白NP-preS1疫苗诱导的preS1抗血清是否可以预防HBV感染,疫苗接种的小鼠在接种两周后接受了腺病毒(AAV-HBV1.3)的第二次攻毒。为了评估抗血清的中和能力,在存在不同免疫血清的情况下,用HBV感染HepG2-hNTCP细胞。结果,体内和体外实验均表明铁蛋白NP-preS1疫苗是有效的预防性疫苗。为确定该疫苗的治疗效果,研究人员建立了携带HBV的小鼠,并每两周用等摩尔的铁蛋白NP-preS1疫苗或SC-preS1免疫四次,结果显示NP-preS1的功能性治愈潜力和肝脏中HBV核心抗原的清除并未伴有肝损伤。因此,铁蛋白-preS1 NPs和CpG在长期HBV感染的小鼠模型中可作为一种有效且非致病的治疗性疫苗。此外,该研究表明,铁蛋白NP-preS1疫苗诱导的Th1反应可能在实现治疗效果中起重要作用:增强IFN-γ反应可能与铁蛋白NP-preS1疫苗协同作用。
●免疫机制研究 ●
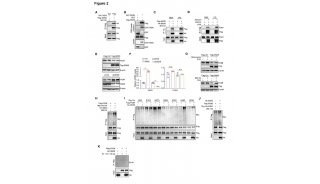
为了了解铁蛋白NP疫苗是如何被宿主免疫系统识别和加工的,研究用荧光素酶标记的铁蛋白NP以追踪其路径。铁蛋白NPs似乎主要被淋巴结中的SIGNR1+DC和SIGNR1+巨噬细胞捕获。
生发中心(GC)的形成对于强烈的抗体反应至关重要,GC B细胞的亲和力取决于CD4+Tfh细胞。对于颗粒抗原免疫,DCs可以将抗原携带到淋巴滤泡以激活B细胞。尽管DC在T细胞活化中起主要作用,但在铁蛋白NP疫苗免疫期间对于早期B细胞活化并非必要的。除DC外,SIGNR1+巨噬细胞可有效捕获铁蛋白NP,在B细胞活化早期和IgG应答中起着至关重要的作用。SIGNR1+巨噬细胞可能直接将抗原带到淋巴滤泡以激活B细胞。研究人员想知道这种迁移是如何受到调控的,由于CXCL13在B细胞滤泡中的大量表达及其在淋巴滤泡迁移中的作用,就鉴定了CXCL13-CXCR5轴。结果发现了一种新的免疫机制:CXCR5依赖性的SIGNR1+巨噬细胞可以携带铁蛋白纳米颗粒抗原,向淋巴滤泡迁移,传递抗原给B细胞并激活B细胞。

图2. B细胞激活和抗体产生需要SIGNR1+巨噬细胞
●小结 ●
作者设计了一种铁蛋白纳米颗粒疫苗,该疫苗在小鼠模型中显示出明显的预防和治疗作用。可以将preS1递送到特定的髓样细胞,包括SIGNR1+树突状细胞(激活T滤泡性辅助细胞)和淋巴窦相关的SIGNR1+巨噬细胞(可以激活B细胞)。高水平和持久的抗preS1反应,可在慢性HBV小鼠模型中有效清除病毒并进行部分血清学转化,为慢性乙肝的功能治愈提供了新的疫苗接种策略。从机制上讲,铁蛋白NP靶向不同的SIGNR1+APC,以诱导T卵泡辅助(Tfh)细胞和B细胞活化,从而提高抗体的产生。重要的是,作者发现了一种新的机制:CXCR5依赖性的SIGNR1+巨噬细胞可以携带铁蛋白纳米颗粒抗原,向淋巴滤泡迁移,传递抗原给B细胞并激活B细胞。针对SIGNR1+常驻DC和LN中的巨噬细胞,这项研究可能会为将来的CHB治疗转化研究提供一个很好的理论支持。
-
产品技术