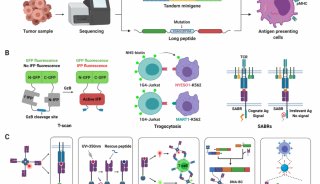
血小板/T细胞活化抗原1
1985年Burns等以活化T细胞为免疫原制备了抗活化T细胞表面抗原的单克隆抗体,并将其中1株单克隆抗体Leo-A1识别的抗原命名为人T细胞系特异性活化抗原1(T lineage-specific activation antigen1, TLiSA1),实验证实TLiSA1参与了CTL细胞的活化与分化〔1-3〕。随后的实验发现TLiSA1也高表达于血小板表面,并与血小板的活化和凝集功能有关,遂将此抗原重新命名为血小板/T细胞活化抗原1(platelet and T cell activation antigen 1, PTA1)〔4〕。1997年我实验室与澳大利亚Newcastle大学癌症研究中心合作成功克隆了人PTA1 cDNA〔5〕。随后,我室又成功克隆了长臂猿和猴PTA1全长cDNA。PTA1基因的克隆为进一步深入探讨PTA1的功能打下了良好的基础。
有趣的是,PTA1的基因序列与1996年DNAX分子与细胞生物学研究院Shibuya等发表的DNAM-1分子(DNAX accessory molecular-1, DNAM-1)序列相同。DNAM-1分子的发现过程同PTA1十分相似,最初作者制备针对人CTL的单抗,发现其中DX11单抗能明显抑制CTL对多种肿瘤细胞系(如Colo205、PA-1、MCF7等)的杀伤作用。Shibuya等首先从外周血单个核细胞(PBMC)中通过DX11单抗亲和层析纯化了DX11识别的抗原,进行了部分蛋白序列测定,以多肽对应的PCR引物扩增出DNAM-1的部分片段,再以32 P标记的探针进行筛选,最终获得了DNAM-1的cDNA序列。Shibuya认为DNAM-1分子是一种新的粘附分子,并可能与信号转导有关〔6〕。
到目前为止,PTA1的配体(PTA1 ligand, PTA1L)尚未基因克隆成功。本实验室已成功构建、表达了PTA1胞膜外区/IgG1 Fc段融合蛋白,通过PTA1/Ig融合蛋白进行的免疫组化及粘附阻断实验证实PTA1配体表达于肿瘤细胞系Colo205细胞膜表面。PTA1配体的鉴定正在进行之中。
PTA1的基因及结构
1997年Sherrington等从以pCDM8为载体的活化Jurkat细胞cDNA文库中,通过Leo-A1单抗panning的方法筛选得到人PTA1阳性克隆〔5〕。人PTA1基因为单拷贝基因,定位于染色体18q22-q23。其cDNA全长1.4kb,5和3端分别有174bp和111bp非编码区。开放读框1 011bp,编码336个氨基酸,包括18个疏水氨基酸的信号肽,成熟蛋白由318个氨基酸组成,属I型跨膜糖蛋白。胞膜外区由232个氨基酸组成,形成2个免疫球蛋白超家族V样结构域,这种结构在免疫球蛋白超家族成员中是唯一的一个。PTA1分子第19和90位的保守半胱氨酸形成链内二硫键,第134和204位的保守半胱氨酸形成第二个链内二硫键,这2个二硫键分别起到稳定胞膜外区2个结构域的作用。在90位和204位半胱氨酸处均存在免疫球蛋白超家族V样结构域的特征性基序Asp-X(Gly或Ala)-X-Try-X-Cys基序。PTA1胞膜外区含有8个潜在的N-糖基化位点和3个潜在的O-糖基化位点。当用内切糖苷酶(Endo F)消化N-连接的糖基后,PTA1的相对分子质量减小了30×103,表明PTA1分子胞膜外区是高度糖基化的,这可能与PTA1参与分子识别有关。PTA1的糖基中含有大量的唾液酸,神经氨酸酶(neuraminidase)消化唾液酸后,其pI由3.5~4.2转变为7.8~8.2。PTA1穿膜区由25个疏水氨基酸组成。胞浆区有61个氨基酸,含有3个酪氨酸、6个丝氨酸和6个苏氨酸,胞浆区尾部含有一段EDIYVNY基序,中央酪氨酸的氨基端有2个带负电荷的谷氨酸和天冬氨酸(ED),羧基端为缬氨酸、天冬酰胺和酪氨酸(VNY),此基序可作为非受体型蛋白酪氨酸激酶(protein tyrosine kinase, PTK)的底物。并可以和蛋白酪氨酸磷酸酶2(protein tyrosine phosphatase 2, PTP2)氨基端的SH2结构域结合。另外,在PTA1胞浆区还存在着酪蛋白激酶Ⅱ(casein kinase Ⅱ)和PKC作用的底物S/T结构。胞浆区的上述结构和基序提示PTA1分子可能参与T细胞和血小板活化的信号转导过程〔4,5〕。人、猿、猴PTA1分子cDNA及蛋白水平的同源性为93%~95%,表明PTA1在生物进化过程中高度保守并可能具有重要的功能。
Burns等通过Leo-A1单抗亲和层析的方法从血小板上纯化了PTA1分子,并进行了蛋白部分序列测定,证实PTA1分子为一全新的分子。通过纯化的PTA1分子再次免疫制备了抗PTA1的单克隆抗体NEWE1和NEWI1〔3〕。而后通过免疫沉淀证实从血小板、Jurkat细胞和T细胞上沉淀下来的分子是相同的。采用流式细胞仪检测发现Leo-A1和NEWE1能结合到PMA刺激的Jurkat细胞膜表面,并且平均荧光强度相同,但NEWI1不能在PMA刺激的Jurkat细胞膜表面着色,当增加Jurkat细胞膜通透性后,NEWI1能使Jurkat细胞着色,并且获得与Leo-A1和NEWE1相同的荧光强度,表明NEWI1识别的表位位于PTA1胞浆区。
用Leo-A1单抗进行的血小板裂解物免疫沉淀证实PTA1相对分子质量为(65~70)×103,蛋白带并不均一。O'Farrell双维电泳(two dimensional gel analysis)表明从活化T细胞免疫沉淀得到的PTA1分子为一弥散产物,pI范围为4.0~6.5,而血小板来源的PTA1分子的pI为3.5~4.2,其差别可能是由于糖基化不同造成的,用神经氨酸酶切除唾液酸后,两种来源的PTA1分子pI均转变为8.0,相对分子质量减少为(60~65)×103〔4〕。Burns等还发现,在不同的细胞系及不同的刺激条件下,通过免疫沉淀有2~3种相关蛋白同PTA1分子共沉淀下来,相对分子质量为(65~90)×103不等,pI4.0~6.5。当用Leo-A1单抗及不同血小板活化剂刺激血小板时,PTA1被快速磷酸化,同时相关蛋白中的部分分子也发生了低水平的磷酸化〔4,7〕。但这些共沉淀分子的特性、作用及结构仍不清楚。这些附加蛋白在人类嗜T淋巴细胞Ⅰ型病毒感染的HUT102B2细胞系中总能被免疫沉淀下来,在PHA刺激的T细胞中有时能沉淀下来,而在Jurkat细胞系中未能沉淀下这种蛋白。这些蛋白的发现总与肌动蛋白(actin)同时存在,提示这些蛋白定位于细胞内。
-
焦点事件