Dev Cell | 溶酶体蛋白质组学揭示NPC1/mTORC1在C型尼曼匹克病中的致病机制






小结与展望

Nat Commun | 糖基化修饰组学揭示高级别浆液性卵巢癌亚型及临床预后分析
2020-12-23

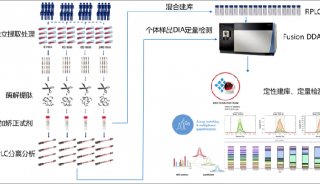
胃癌新靶点:南京医科大学尤强组揭示琥珀酰化修饰在胃癌中的重要调控机制
2020-09-07

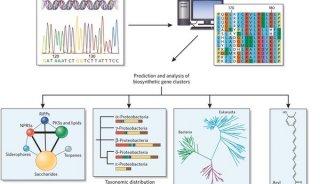
Development Cell 前瞻性聚焦 | 代谢物在蛋白质修饰组学及细胞生长信号中的调控作用
2020-09-02

专家点评 | 高友鹤教授:透过两篇最新文章,看尿液蛋白标志物应用
2020-12-18

Nature | 一键切换“节能”模式,蛋白质组学揭示饥饿状态下细胞的蛋白组重构机制
2020-07-06

参考文献:

文章作者
推荐