项目文章| 中国海洋大学刘尊英团队揭示植物乳孢杆菌介导的生长特性和抑菌能力
前言
2022年2月,中国海洋大学食品科学与工程学院刘尊英教授课题组在《Foods》期刊发表的题为“Dissecting of the AI-2/LuxS Mediated Growth Characteristics and Bacteriostatic Ability of Lactiplantibacillus plantarum SS-128 by Integration of Transcriptomics and Metabolomics”的研究成果,通过转录组学和代谢组学等研究方法,发现植物乳孢杆菌可以通过AI-2/luxs介导的群体感应(QS)系统来调节其生长特性和代谢,该系统是参与食品安全的正调控因子,这将有助于研究植物乳孢杆菌的生物保护控制潜力,特别是在食品工业生物技术中的应用。

基本信息
中文标题:通过转录组学和代谢组学的整合剖析植物乳杆菌 SS-128 的 AI-2/LuxS 介导的生长特性和抑菌能力
发表期刊:Foods
影响因子:4.350
作者单位:中国海洋大学
涉及的欧易/鹿明生物服务产品:转录组测序、GC-MS/LC-MS非靶向代谢组学
研究背景
乳酸菌(LAB)是自然界中安全且广泛的微生物,主要用于发酵剂和益生菌。植物乳杆菌作为乳酸菌的一种,具有对复杂食物基质环境的抗性,并能快速增殖,表明其具有较高的工业应用潜力。与其他菌株不同,植物乳孢杆菌可以通过涉及cysK酶的直接巯基化从半胱氨酸合成同型半胱氨酸,以确保s-腺苷蛋氨酸(SAM)甲基的再生。由于cysK酶的独特功能与luxS非常相似,从而推测它有助于提高植物乳杆菌的生长能力和抗逆性,因此通过了解AI-2/luxs介导的QS系统对LAB的生长特性和抑菌能力的调控机制,为提高其生物保存功能提供依据。
研究思路
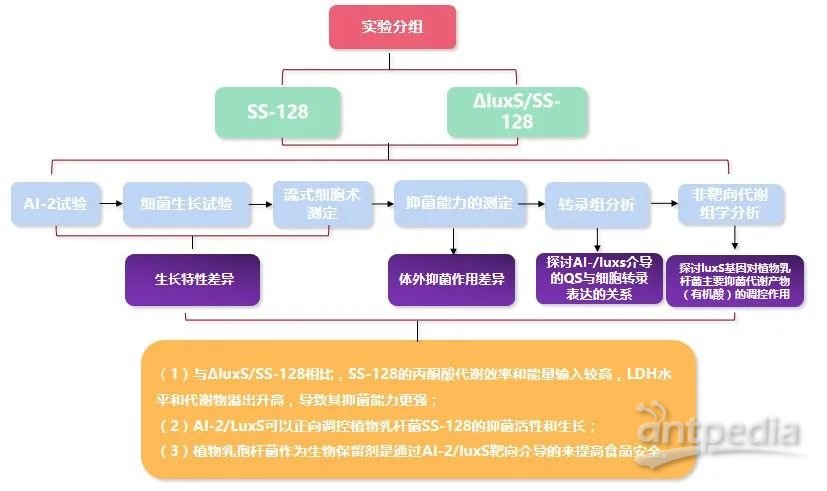
实验方法
研究材料:SS-128的luxS-突变体
1)AI-2试验
2)细菌生长试验
3)流式细胞术测定
4)抑菌能力的测定
5)转录组分析
6)非靶向GC-MS/LC-MS代谢组学分析
研究结果
1
luxS基因敲除的确认
为了确认luxS作为一种s-核糖体同型半胱氨酸裂解酶的功能,作者构建了一个luxS的敲除突变体,然后利用生物发光法检测植物乳杆菌SS-128和∆luxS/SS-128上清液中AI-2的水平。luxS基因编码一种参与蛋氨酸代谢的酶,其缺失最终导致AI-2的缺失。如图1c所示,植物乳杆菌SS-128的AI-2积累浓度在指数期后期达到最高水平,在稳定期缓慢下降。此外,与结合转录水平表达分析的∆luxS/SS-128相比,SS-128的AI-2活性在14h时显著增加(图1d)。这些数据表明,luxS的缺失导致了AI-2合成的残疾。

图1 | SS-128和∆luxS/SS-128中luxS基因的两步同源重组、PCR扩增、AI-2活性和luxS基因的转录
2
植物乳杆菌SS-128和∆luxS/SS-128的生长特性
植物乳杆菌通过生产主要由有机酸组成的抑菌化合物,在阻碍食品系统中的致病菌和腐败菌的活性方面具有很大的潜力。因此,作者比较了无细胞上清液对植物乳杆菌SS-128和∆luxS/SS-128的大肠杆菌、波罗氏希瓦氏菌、金黄色葡萄球菌和约氏不动杆菌的抑菌能力(图2d)。如图2d所示,对照组没有抑菌环,说明MRS肉汤对食源性腐败和致病菌没有抑菌能力。相比之下,SS-128在细菌周围表现出一个清晰的抗菌环,并且在14h后大于∆luxS/SS-128。特别是与∆luxS/SS-128(15.18mm)相比,SS-128在24h时收集的CFS对波罗的海链球菌(16.41mm)具有显著的抑菌活性(p<0.05)。通过上述结果可知,SS-128的代谢物具有较强的抑菌能力。
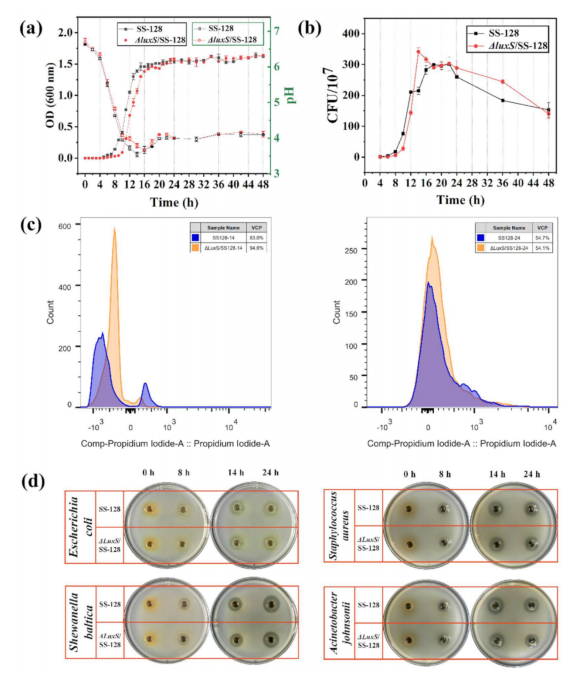
图2 | 流式细胞术检测植物细胞密度、活细胞数、VCP,以及SS-128和∆luxS/SS-128对大肠杆菌、波罗的海、金黄色葡萄球菌和约氏氏菌的抑制区图
3
植物乳杆菌SS-128和∆luxS/SS-128的体外抑菌作用
为了进一步探讨luxS基因对植物乳杆菌产生的主要抑菌代谢物(有机酸)的调控作用,作者测定了植物乳杆菌SS-128和∆luxS/SS-128的有机酸产量。结果表明,敲除luxS基因后,植物乳杆菌SS-128的有机酸产量显著降低(图3a,b)。在12-16h内,植物乳杆菌SS-128的乳酸产量比luxS突变型高20.96%~64.12%(p<0.05)(图3a)。这些结果表明,植物乳孢杆菌中乳酸和PLA的产生可能与AI-2/LuxS系统的调控有关。在作者的研究中,与∆luxS/SS-128相比,SS-128在14h后的活菌数量较少,抑菌能力更强,这进一步证实了luxS对植物乳杆菌生长特性和代谢的调控作用。图3c显示了培养8、10、12、14、16和24h后对植物乳杆菌中LDH活性的评价。与∆luxS/SS-128(2.32mU/104细胞)相比,SS-128在10h后LDH活性显著升高(4.25mU/104细胞)(p<0.05)。在指数生长期,SS-128的LDH活性保持稳定,且显著高于∆luxS/SS-128(p<0.05)。
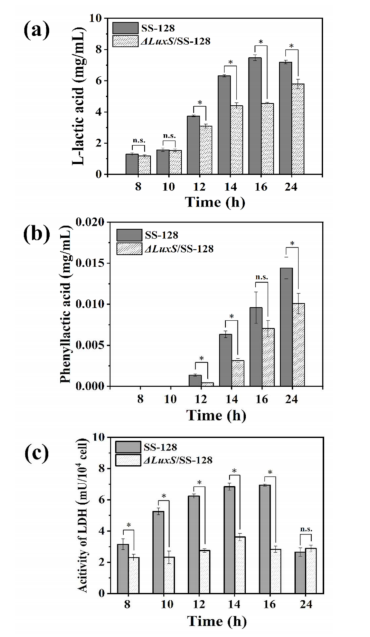
图3| HPLC法检测SS-128和∆luxS/SS-128中l-乳酸和PLA)的胞外浓度及LDH活性
4
植物乳杆菌SS-128和∆luxS/SS-128的有机酸生产研究
探讨AI-/luxs介导的QS与细胞转录表达水平之间的关系是影响细菌代谢物积累的前提。作者通过识别无luxS基因的植物乳孢杆菌的表达谱,并对野生型和突变型进行了转录组分析。在PCA模型中,∆luxS/SS-128和SS-128之间存在显著性差异(图4a)。第一主成分和第二主成分之间的差异分别为77.93%和11.78%。与不同水平表达的SS-128相比,在∆luxS/SS-128中共鉴定出157个基因(p<0.05)(图4b)。如图4c所示,KEGG富集分析发现,敲除luxS基因后一些通路发生了显著的变化。

图4 | PCA分析、火山图和KEGG通路
5
植物乳杆菌SS-128与∆luxS/SS-128的转录组学分析
通过采用非靶向GC-MS和LC-MS代谢组学分析进一步探讨植物乳杆菌SS-128对luxS基因代谢过程的适应性。GC-MS、LC-MS正离子模式和负离子模式在样品中检测到的代谢物总数分别为357、2316和1330个。图5a中的野生型和突变型明显分离。此外,OPLS-DA模型明确分离了第一主成分(PC),各组间的差异分别为38.7%(GC-MS)和54.7%(LC-MS)。这些数据表明,由于luxS基因被敲除后,细胞代谢发生了显著的变化(图5b)。OPLS-DA模型筛选出了两组中差异表达的代谢物。对GC-MS筛选出的110种代谢物进行结构鉴定,其中26个代谢物显著上调,84个代谢物显著下调(p<0.05)(图5c)。LC-MS共鉴定出464个差异表达的代谢物。
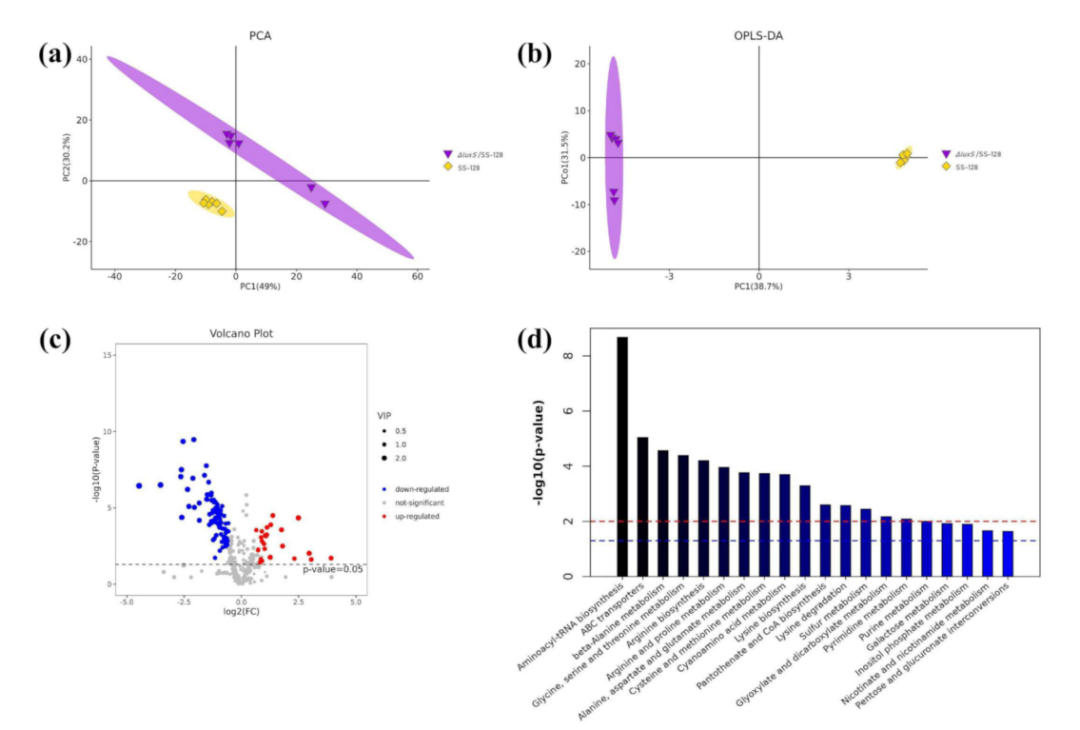
图5| GC-MS比较luxS突变组与对照组的代谢物含量的变化
6
植物乳杆菌相关基因和代谢表达水平的变化
如图6所示,l-半胱氨酸仅由丙酮酸维持,而其他相关代谢途径的代谢物含量显著降低。这种现象类似于汉斯·科恩伯格在《生物化学》中描述的“退化序列”,即一些关键的中间体在生长过程中被去除,其他相关的代谢物被用于中间体的净生产。这与之前的研究结果一致,即与添加半胱氨酸的细胞相比,半胱氨酸缺乏的细胞表现出超过100倍的氧化应激增加,并与细胞生长的保护机制有关。由于丙酮酸是连接碳水化合物或氨基酸的利用与能量生成和生物合成途径的主要代谢连接点,因此关键中间代谢产物的含量需要通过辅助反应及时补充。由于蛋氨酸循环的中断,糖酵解和三羧酸循环被上调,以“维持”ATP的能量和NADPH的降低能量。与丙酮酸代谢和三羧酸循环相关的DEGs,如pckA、ME2、fumA和frdA,均表达上调。
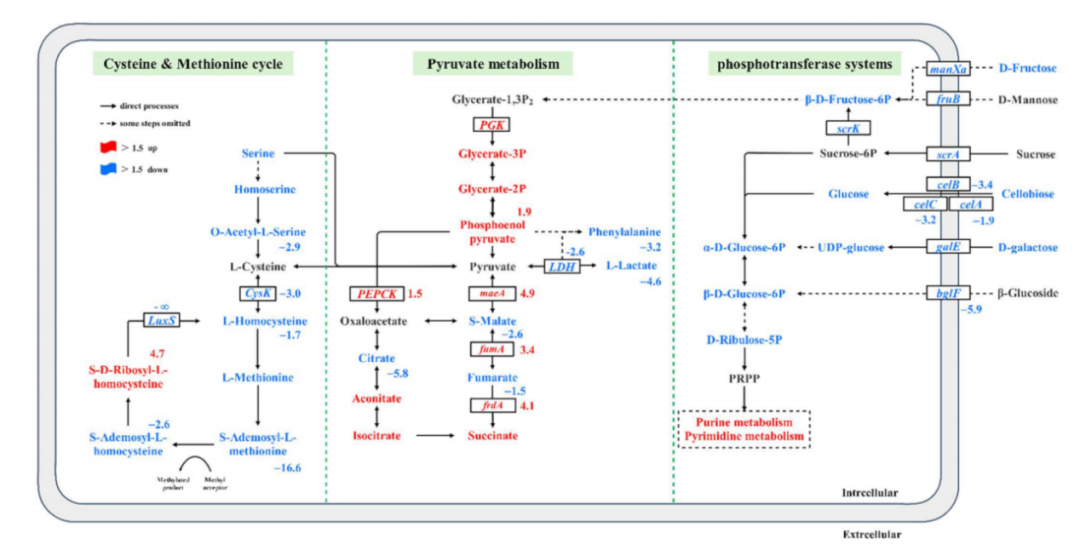
图6 | 植物乳杆菌相关基因和代谢表达水平的变化
研究结论
多组学分析表明,由于SS-128的丙酮酸代谢效率和能量输入高于∆luxS/SS-128,且其LDH水平等升高,导致其抑菌能力更强。AI-2/LuxS可以正向调控的抑菌活性和生长,所以SS-128可通过AI-2/luxS的介导从而提高食品安全,但仍需要进一步研究探索。
小鹿推荐
LAB作为生物防腐剂潜力的科学研究一直引起了人们的关注。本篇文章利用菌株开发策略中涉及到的的非靶向GC-MS/LC-MS代谢组学和转录组学方法比较SS-128及突变体丙酮酸代谢效率、LDH水平等,分析其抑菌能力可为提高食品的安全和质量提供新的机会。

上海鹿明生物科技有限公司多年来,一直专注于生命科学和生命技术领域,是国内早期开展以蛋白组学和代谢组学为基础的多层组学整合实验与分析的团队。目前在多层组学研究已经有了成熟的技术方法,欢迎各位老师前来咨询哦~
(长按扫码添加鹿明工程师)
猜你还想看
1、项目文章 | 转录组学+蛋白组学助力甘农大孙万仓教授课题组研究白菜型冬油菜低温胁迫机制2、项目文章 | Sci. Total Environ. 转录组+代谢组学助力冯丽萍课题组探究双酚F(BPF)暴露肠道毒性机制
3、Circulation | 转录-代谢-脂质:多组学研究描绘肥厚型心肌病的病理图谱
4、项目文章 | 转录组学+蛋白组学为改善肝葡萄糖脂代谢机制提供了新见解