项目文章MOL CANCER(IF:37.3)| TMT标记定量蛋白质组学揭示LH1在局限迁移转移中的新机制


结缔组织增生与致密胶原间质的形成是评价癌症患者治疗效果的重要指标。已知转移性肝肿瘤组织硬度高于原发性结直肠癌组织,血管紧张素转换酶抑制剂降低转移性肝癌硬度可提高转移性结直肠癌患者的生存时间。局限性迁移不仅发生在局部侵袭时,也发生在静脉内渗、外渗和转移灶形成时。过多的细胞外基质沉积和刚度增加是实体瘤如肝细胞癌(HCC)和胰管腺癌(PDAC)的典型特征。这些条件为肿瘤细胞的迁移和转移创造了有限的空间,但限制性迁移的调控机制尚不清楚。

2023年1月,香港城市大学周智航教授在Molecular Cancer期刊发表题为 “Lysyl hydroxylase LH1 promotes confined migration and metastasis of cancer cells by stabilizing Septin2 to enhance actin network ”(IF:37.3)的研究成果,通过基于LC-MS蛋白质组学研究方法,揭示了LH1(赖氨酸羟化酶)在HCC和PDAC局限迁移转移中的新的分子机制,为肿瘤的诊断和治疗提供了新的策略。

这项研究通过蛋白质组学分析发现LH1在HCC组织中过表达,LH1高表达与HCC和PDAC患者预后不良均相关,发现LH1在三维仿生模型中可以增强细胞的侵袭,在更硬的环境中形成球体和体内转移。证明LH1增加了SEPT2的稳定性,从而促进了Septin与F-actin网络的形成,以及HCC和PDAC细胞的受限迁移,这为癌症治疗带来新方向。


研究材料
(1) 人类肝癌和胰腺癌细胞系
(2) 样本:153名肝细胞癌,63名胰脏导管腺癌患者
研究技术
(1) TMT标记定量蛋白质组学分析
(2) NGS转录组测序分析

1. LH1的高表达与HCC和PDAC患者预后不良相关
文章通过对8个HCC组织及相应癌旁组织的蛋白组学分析,发现LH1是HCC组织中过表达最显著的蛋白之一(图1A),HCC组织中其他高表达蛋白GO分析显示,差异表达蛋白在分子功能上富集(图1B)。通过Western blot证实了LH1在HCC组织中高表达(图1C)。此外,根据癌症基因组图谱(TCGA)数据,LH1似乎在HCC肿瘤中高表达(n = 371)(图1D)。KM-plotter分析显示,LH1高表达与HCC(图1E)、PDAC(图1F)、胃腺癌和肺腺癌患者预后不良有关。且LH1也在肿瘤栓子中强烈表达(图1I)。上述研究结果揭示了LH1的表达水平与HCC和PDAC患者的大血管侵犯和预后不良有关。
图1 LH1高表达与HCC和PDAC患者预后不良相关
2. LH1促进癌细胞的局限迁移
LH1超表达可以显著促进肝癌(图2)或PANC1细胞通过8μm的毛孔transwell迁移试验(图2A和B)。上述研究结果揭示了LH1可能促进癌细胞的局限迁移。
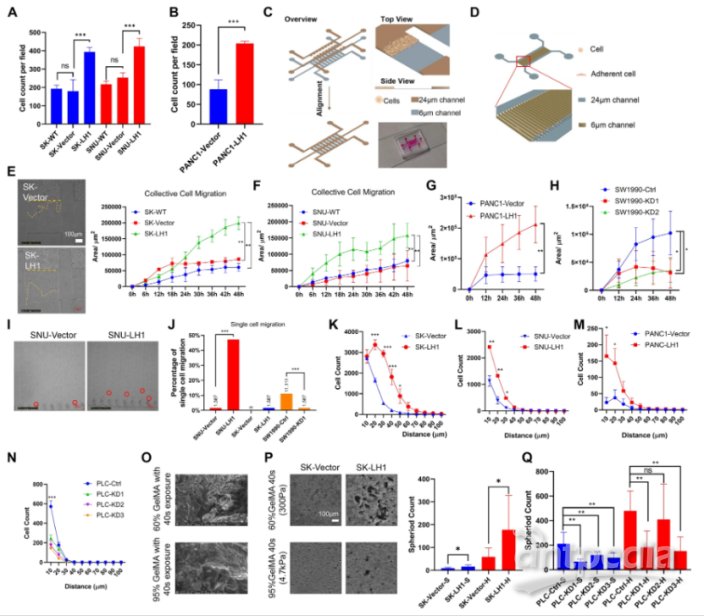
图2 LH1过表达在多维水平上促进限制性迁移
3. LH1与SEPT2结合并增强肌动蛋白聚合
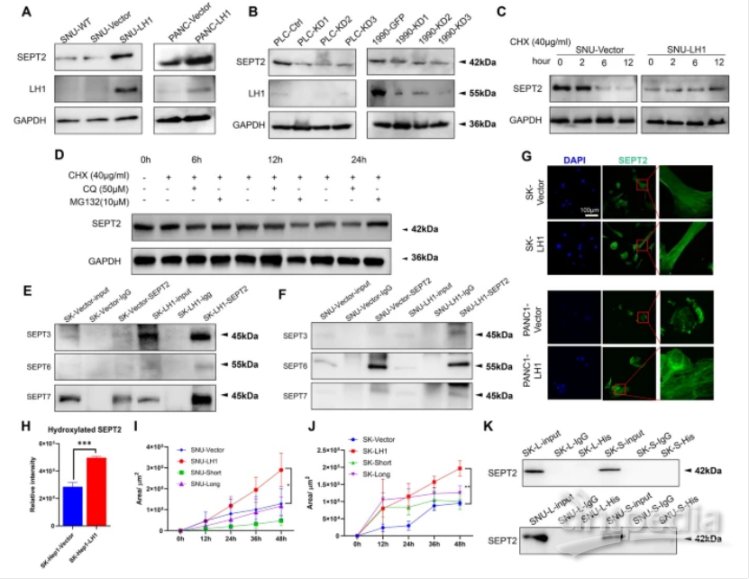
为了揭示LH1调控肝癌细胞局限性迁移的机制,文章通过共免疫沉淀获得了与LH1结合的蛋白复合物。并通过质谱分析发现,LH1可以特异性结合纤维相关蛋白SEPT2(图3A)。进一步的免疫共沉淀实验证实,LH1和SEPT2蛋白可以在HCC细胞(图3B)和PDAC细胞(图3C)中结合。慢病毒转染细胞后表达融合蛋白hLH1-3xGGGGS-GFP和hSEPT2-3xGGGGS-mCherry,可以观察到FRET现象(图3D)。
此外,研究发现LH1可以增强HCC细胞中F-actin网络的形成(图3E和F),而敲低LH1则导致F-actin网络的减少(图3G)。上述研究结果表明LH1可以与SEPT2结合并增强微丝的结构。

图3 LH1与SEPT2结合,增强肌动蛋白聚合
4. LH1利用其羟化酶功能稳定SEPT2
研究发现过表达LH1可增加肝癌和PDAC细胞中SEPT2的蛋白丰度(图4A)。而敲除LH1导致了SEPT2的下调(图4B)。这些结果表明SEPT2表达发生了翻译后修饰。此外,LH1过表达增加了SEPT2与septin家族其他成员的结合(图4E和F)。免疫荧光染色显示,在HCC和PDAC细胞中,LH1可以增强septin网络(图4G),而敲低LH1可以抑制septin网络。通过质谱分析发现,LH1可以增加SEPT2蛋白的羟基化(图4H)。上述研究结果表明,LH1羟化并稳定SEPT2蛋白,以增强septin网络,这取决于羟化酶结构域。
图4 LH1利用其羟化酶功能稳定SEPT2
5. 敲低SEPT2抑制了LH1的作用
研究发现敲低SEPT2可以显著抑制对照组细胞和LH1过表达细胞的集体受限迁移(图 5A和B),敲低LH1可以缩小对照组细胞和LH1过表达细胞之间的差距。与此同时,抑制SEPT2的表达可以减少癌细胞的3D侵袭,尤其是LH1过表达的细胞(图5C和D)。在刚性球形成模型中,SEPT2敲低的细胞形成的球体更少,在硬凝胶中更明显(图5E和F)。transwell迁移实验也显示敲低SEPT2可以显著抑制细胞的迁移(图5G和H)。SEPT2敲低SK-Hep1和SNU449细胞的f -肌动蛋白网络减少,而SEPT2敲低可以降低LH1对f -肌动蛋白强度的影响(图5I和J)。共免疫沉淀实验显示,SEPT2可以与α-肌动蛋白结合,但不能与β-肌动蛋白结合;LH1过表达增强了这一点(图5K和L),且PDAC细胞中SEPT2和α-actin之间存在结合(图5M)。上述研究结果表明,SEPT2通过调节肌动蛋白聚合介导了LH1在限制性迁移中的功能。

图5 敲低SEPT2可抑制过表达LH1的SK-Hep1 (A)和
SNU449 (B)细胞的限制性迁移
6. LH1通过SEPT2促进体内转移
为了检验LH1在体内对肿瘤转移的作用,研究采用肝原位注射模型。将lh1过表达和载体SK-Hep1细胞注射到非肥胖严重糖尿病合并免疫缺陷(NOD-SCID)小鼠的肝脏。研究结果发现过表达lh1的细胞可以形成更大的肿瘤块(图6A和B)。来源于LH1过表达细胞的肿瘤大多形成了多个结节(图6C),且发生肺转移灶(图6D)。HE染色证实,过表达lh1组形成肝脏肿瘤和肺转移更多(图6E)。最后,IHC染色显示LH1和SEPT2在原发肿瘤和转移灶中均高表达(图6F,)。上述研究结果证明了LH1能够促进HCC细胞的体内转移。

图6 在实验结束时,LH1通过SEPT2 A在荷瘤小鼠体内成像促进体内转移。B对照组或过表达lh1组在指定时间点的生物发光强度。C多中心肿瘤(超过1个肿瘤中心或远处转移)小鼠的百分比。各组肝脏亮视野下D大体像及生物发光像。E HE染色显示各组肝、肺肿瘤。F LH1载体组、过表达组和SEPT2敲低组肺转移灶的生物发光强度。
7. LH1和SEPT2的共表达与HCC和PDAC患者的最差预后相关
与LH1一样,我们通过KM-Plotter在线数据库发现,在HCC(图7A)、PDAC(图7B)、胃腺癌(图7C)和肺腺癌(图7D)患者中,SEPT2高表达水平与预后不良相关。卡方分析显示,SEPT2高表达与BCLC晚期肿瘤分期、微血管浸润及LH1表达水平相关(表1、图7E、F)。HCC组织IF染色证实LH1与SEPT2共表达(图7G)。此外,研究发现PDAC组织中LH1与SEPT2表达呈正相关(n = 62)(图7H、I), PDAC组织中IF染色证实LH1与SEPT2共表达(图7J)。Kaplan-Meier生存分析显示,LH1和SEPT2高表达的亚组总生存时间最短(图7K),无病生存时间最短(图7L)。上述研究结果发现在HCC和PDAC组织中,SEPT2的表达水平均与LH1呈正相关,这两种蛋白的结合定义了一个预后最差的亚组。

图7 根据KMplotter数据库,在HCC (A)、PDAC (B)、
胃(C)和肺腺癌(D)患者中,LH1和SEPT2的
高表达与短OS时间相关

这项研究证明LH1增加了SEPT2的稳定性,从而促进了Septin和F-actin网络的形成,从而促进了HCC和PDAC细胞的受限迁移。目前的工作揭示了LH1在癌细胞局限迁移和转移中的新的分子机制,有望为肝细胞癌和胰腺导管腺癌的诊断或治疗提供新的策略。

文章推荐
由鹿明生物提供的基于LC-MS的TMT蛋白质组分析揭示了LH1在癌细胞局限迁移和转移中的新的分子机制,为肿瘤的诊断和治疗提供了新的策略。
参考文献
Zihan Yang et al. Lysyl hydroxylase LH1 promotes confined migration and metastasis of cancer cells by stabilizing Septin2 to enhance actin network. Molecular Cancer, 2023.DOI: doi:10.1186/s12943-023-01727-9
.
文末看点|lumingbio
上海鹿明生物科技有限公司是欧易生物旗下从事蛋白质组及代谢组质谱检测的专业质谱组学服务公司。公司建有国内第一个空间代谢组商业服务平台,深耕质谱组学检测分析,具体包括空间代谢组、双平台代谢组、靶向代谢组、TMT标记定量蛋白组、翻译后修饰蛋白组、4D-DIA蛋白组、单细胞及超微量蛋白组、空间蛋白组等。创新质谱组学平台广泛应用于机制解析、分型诊断、标志物筛选、药靶发掘等多个领域。公司并先后获得高新技术企业、上海市专精特新企业并建有院士专家工作站,自有包括tims tof pro2在内的各类大型质谱近二十台套,年服务项目超2000项。鹿明生物协助合作伙伴发表SCI论文近千篇,成功打造以硬数据、好服务为基础,以空间代谢组为特色的质谱组学检测服务公司品牌。

精彩往期推荐
BAM(IF=16.874)| 外泌体蛋白质组探究壳聚糖寡糖促进外周轴突再生机制
2023-06-01
2023-05-26
外泌体蛋白质组|蛋白质组学研究助力阿尔兹海默症生物标志物筛选
2023-05-18
2023-05-11
END
空气 撰文
嫣然 审核
欢迎转发到朋友圈
本文系鹿明生物原创解读
转载请注明本文转自鹿明生物

我知道你在看哟

![]()
点“阅读原文”了解更多