活细胞荧光成像的新型标记法及其在STED中的应用(三)
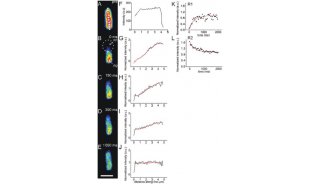
细胞骨架如微管、微丝等一直是生命科学研究的重点。近期Johnsson等科学家将SiR直接标记于与微管和微丝分别特异性结合的小分子docetaxel和jasplakinolide,即形成SiR-tubulin和SiR-actin,实现了在不对细胞或组织进行任何转染或基因组修饰的条件下直接进行活细胞成像[18](图9)。SiR-tubulin和SiR-actin仍然保留了SiR的优良特性,非常适用于STED成像(图10)。SiR-tubulin标记人成纤维活细胞中的微管后, STED超高分辨率显微镜揭示了细胞质中及中心体上tubulin的定位及结构信息。在这种标记和成像方法下,细胞质中微管的粗细测量为39±10 nm, 这是目前活细胞中微管成像的最高分辨率。STED成像也清晰的揭示了中心体上的微管以9个亚复合体排布成直径约176±10 nm的环形(图10a,b),两个临近亚复合体之间的夹角成39°±13°(图10c),这些数据与之前用电子显微镜研究得到的数据是一致的[19]。SiR-actin标记活的大鼠海马区原代神经元后,STED超高分辨率显微镜揭示了微丝在轴突上以181±20 nm的区间成周期性排布(图10d-f),这与之前用固定的样品得到的结果是一致的[20]。这些数据充分说明了SiR-actin和SiR-tubulin在活细胞超高分辨率显微镜成像中使用的便捷性及可靠性。目前SiR-tubulin和SiR-actin已经被Spipochrome公司商品化,使用方法也有非常详细的描述。

图9. SiR-tubulin和SiR-actin。a, SiR-tubulin和SiR-actin的分子结构。b,SiR-tubulin和SiR-actin只有在分别结合了微管或微丝后才能发出荧光。c,SiR-tubulin和SiR-actin标记的人成纤维细胞,结构照明成像,标尺,5 mm。

图10. SiR-tubulin和SiR-actin标记的活细胞的STED成像。(a)人成纤维活细胞中心体上微管的STED代表性图像(已经过Richardson-lucy反卷积运算)。(b)人和小鼠的中心粒的直径。(c)人和小鼠中心粒中临近的两个微管亚复合体之间夹角。(d)16天的大鼠海马区元代神经元在用SiR-actin染色后的STED原始图像。(e-f)微丝在神经元轴突上以间隔为181±20 nm的距离成周期性分布。
总结
新的荧光探针和成像技术的发展,极大地加快了生命科学探索的步伐,并将继续为细胞生命活动提供极其重要的新见解。近十年中,超高分辨率和单分子显微镜发展迅速并越来越成熟化,可以预见在不就的将来利用超高分辨率显微镜对活细胞进行成像将成为非常常规的科研手段。作为在这个方向迈出的一步,各种各样的新型活细胞标记方法和荧光探针的研发也得到了越来越多的科学家的青睐和重视。总体来说,SNAP-tag等标签标记方法已经在活细胞系统的研究和操控中显示出极大的潜力。而SiR等新型染料的研发必将进一步推进超高分辨率显微镜在活细胞成像中的应用。
参考文献
13.Komatsu, T., Johnsson, K., Okuno, H.,Bito, H., Inoue, T., Nagano, T., and Urano, Y. (2011). Real-time measurementsof protein dynamics using fluorescence activation-coupled protein labelingmethod. J Am Chem Soc 133, 6745-6751.
14.Sun, X., Zhang, A., Baker, B., Sun, L.,Howard, A., Buswell, J., Maurel, D., Masharina, A., Johnsson, K., Noren, C.J.,et al. (2011). Development of SNAP-tag fluorogenic probes for wash-freefluorescence imaging. Chembiochem 12,2217-2226.
15.Correa, I.R., Jr. (2014). Live-cellreporters for fluorescence imaging. Curr Opin Chem Biol 20, 36-45.
16.Gong, H., Kovar, J.L., Baker, B., Zhang,A., Cheung, L., Draney, D.R., Correa, I.R., Jr., Xu, M.Q., and Olive, D.M.(2012). Near-infrared fluorescence imaging of mammalian cells and xenografttumors with SNAP-tag. PLoS One 7,e34003.
17.Lukinavicius, G., Umezawa, K., Olivier, N.,Honigmann, A., Yang, G., Plass, T., Mueller, V., Reymond, L., Correa, I.R.,Jr., Luo, Z.G., et al. (2013). A near-infrared fluorophore for live-cellsuper-resolution microscopy of cellular proteins. Nat Chem 5, 132-139.
18.Lukinavicius, G., Reymond, L., D'Este,E., Masharina, A., Gottfert, F., Ta, H., Guther, A., Fournier, M., Rizzo, S.,Waldmann, H., et al. (2014). Fluorogenic probes for live-cell imaging of thecytoskeleton. Nat Methods 11,731-733.
19.Paintrand, M., Moudjou, M., Delacroix,H., and Bornens, M. (1992).
Centrosome organization and centriole architecture:their sensitivity to
divalent cations. J Struct Biol 108, 107-128.
20.Xu, K., Zhong, G.,
and Zhuang, X. (2013).Actin, spectrin, and associated proteins form a
periodic cytoskeletal structurein axons. Science 339, 452-456.