通过调控免疫检查点重塑肿瘤局部免疫微环境
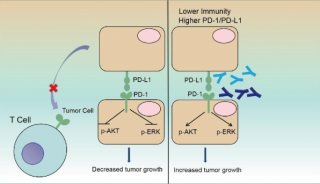
肿瘤细胞通过诱导免疫检查点的异常表达逃避免疫细胞攻击。靶向T细胞免疫检查点PD1/PDL1的免疫疗法可恢复CD8+T细胞功能,成为当前最受期待的有可能治愈恶性肿瘤的方法,但大部分患者因为原发或继发耐药导致肿瘤侵袭进展,免疫治疗耐药原因的探究成为当前研究的热点。
既往研究表明免疫微环境中的免疫细胞表型是预测其临床反应的重要生物标记物,T细胞除了被PD1/PDL1抑制外,还受交替极化的M2样肿瘤相关巨噬细胞 (TAMs) 的抑制。通常,经典激活的促免疫巨噬细胞(M1)和替代激活的抑制免疫巨噬细胞(M2)是由辅助T细胞的细胞因子库驱动的巨噬细胞极化的两种不同状态。M1巨噬细胞产生促炎和免疫刺激性细胞因子,如白介素IL-12、TNF-α等,参与辅助T细胞(Th1)对感染及肿瘤的免疫反应。而肿瘤相关的巨噬细胞(TAMs)更类似于M2极化的巨噬细胞,在侵袭性癌症中可能占肿瘤总量的50%,可通过生成包括但不仅限于TGF-β、IL-10、VEGF、CCL2、CXCL12、CXCR4、MMPs等多种生长因子、细胞因子,重塑细胞外基质,从而调节肿瘤生长、迁移以及血管生成。
CD47被认为是巨噬细胞的免疫检查点,已经证实的两个主要配体是信号调节蛋白α(Sirpα)和血栓反应蛋白-1 (TSP-1),两者的结合可抑制巨噬细胞的吞噬功能。CD47广泛存在于各种类型的肿瘤细胞中,使其可能成为广泛适用的靶标,目前靶向CD47活化巨噬细胞吞噬作用的研究很多,但对其在TAMs向M2极化中的作用和机制知之甚少。
2021年5月21日,美国肯塔基州路易维尔大学肿瘤中心Douglas C. Dean教授及其团队在Science Advances杂志上发表文章(第一作者是山东第一医科大学第一附属医院郭燕医生),题为:Zeb1 induces immune checkpoints to form an immunosuppressive envelope around invading cancer cells。研究发现,Zeb1诱导侵袭性肺腺癌细胞中PDL1和CD47的表达,CD47驱动相邻TAMs的M2极化,进一步抑制了T细胞的功能,因此在侵袭性肿瘤细胞周围塑造了免疫抑制微环境,促使肿瘤细胞的免疫逃逸,亦有可能是T细胞免疫检查点抑制剂耐药的原因。

恶性肿瘤侵袭依赖于转录因子Zeb1驱动的上皮间质转化(EMT),且EMT的发生与免疫治疗耐药相关,这提示侵袭前沿的癌细胞是免疫治疗的靶标,但尚未有研究去证实,也不清楚侵袭前沿EMT的发生是否与TAMs的M2替代极化有关。鉴于上述原因,此研究在K-Ras驱动的肺腺癌(AC)追踪了Zeb1与免疫检查点和肿瘤微环境中免疫细胞浸润的关系,尤其是对比分析了K-Ras突变合并Zeb1单基因缺失形成的肺腺瘤小鼠模型中的免疫检查点表达和免疫细胞浸润情况。结果表明Zeb1的表达诱导EMT发生的同时,在侵袭前沿诱导肿瘤细胞高表达免疫检查点CD47、PDL1,经CHIP实验表明Zeb1基因与PDL1和CD47均存在相互结合的序列基础,证实了Zeb1靶向调控PDL1、CD47的表达(图1)。

图1:Zeb1调控免疫检查点PDL1、CD47的表达
进一步免疫荧光检测到肿瘤侵袭前沿,Zeb1高表达的局部CD47与M2样TAMs空间上共定位,且体外细胞培养中应用CD47抗体可抑制巨噬细胞的M2极化,提示CD47的高表达导致TAMs向M2极化,伴有CD8+T细胞局部缺失共同造成了局部免疫抑制性微环境(图2)。同时研究中还检测到侵袭前沿微环境中的巨噬细胞表达PDL1,进一步抑制了局部的T细胞。

图2:CD47与M2巨噬细胞空间上共定位
综上,此研究结果强调了侵袭前沿的癌细胞可能是免疫检查点治疗的靶标, Zeb1诱导的免疫检查点PDL1和CD47,其在侵袭前沿的表达可能预测患者对免疫治疗的反应,为PD1/PDL1耐药患者寻找替代或联合治疗靶点提供理论依据。
-
科技前沿
-
项目成果

-
焦点事件