昆虫病原线虫发育相关基因的鉴定
实验概要
本实验构建了昆虫病原线虫全长的cDNA文库,构建的cDNA文库分别与诱导和未诱导的处理下提取的 mRNA 制备的探针进行杂交,获得差异表达的基因。
主要试剂
1. 酶类及分子量标准
1) 高保真酶Easy-A high fidelity cloning enzyme,Merck公司Stratagene系列;
2) Taq DNA Polymerase,上海申能博彩生物技术有限公司;
3) DL 2000 DNA Marker,宝生物工程(大连)有限公司。
2. 主要试剂(盒)
1) TOPO TA Cloning Kit for Sequencing,美国Invitrogen公司;
2) TaKaRa Random Primer DNA Labeling Kit Ver. 2.0,TaKaRa 公司;
3) [α-P32] dCTP(3µCi/pmol),北京福瑞生物工程公司;
4) dNTP,上海申能博彩生物技术有限公司;
5) 杂交液,北京鼎国生物技术有限责任公司;
6) 琼脂糖(Agarose),进口分装,上海Yito公司;
7) 胰蛋白胨(bacto-tryptone)、酵母浸出粉(bacto-yeast extract),英国OXOID公司。
8) 琼脂粉,广东环凯微生物科技公司;
9) 卡那霉素(kanamycin),美国Sigma公司;
10) 注射用硫酸链霉素,山东鲁杭医药有限公司;
11) 溴化乙锭(ethidium bromide,EB),华美生物工程公司;
12) 其他试剂为国产分析纯。
3. 主要溶液
1) 溴化乙锭(EB)溶液(10 mg/mL):称取EB约300 mg于试剂瓶中,加入双蒸水30 mL,充分混匀,4℃备用。
2) 卡那霉素储存液(50 mg/mL):称取卡那霉素1 g,溶于20 mL水中,充分混匀,过滤除菌,分装贮存于-20℃。
3) 50×TAE电泳缓冲液
Tris 242 g
EDTA (0.5 mol/L,pH 8.0) 100 mL
冰乙酸 57.1 mL
加水定容至1000 mL
4) 20×SSC溶液:称取88.23 g二水柠檬酸钠,175.32 g NaCl,溶解于800 mL双蒸水中,用10 M NaOH调PH至7.0,定容至1 L。高压灭菌15 min,室温保存。
5) 洗膜液I 〔2×SSC,0.1%(W/V)SDS〕:于800 mL双蒸水中,加入100 mL 20×SSC,10 mL 10%SDS,定容至1 L,室温保存。
6) 洗膜液II 〔1×SSC,0.1%(W/V)SDS〕:于800 mL双蒸水中,加入50 mL 20×SSC,10 mL 10%SDS,定容至1 L,室温保存。
7) 洗膜液III 〔0.1×SSC,0.1%(W/V)SDS〕:于800 mL双蒸水中,加入5 mL 20×SSC,10 mL 10%SDS,定容至1 L,室温保存。
4. 培养基
1) LB培养基
Tryptone 10 g
Yeast Extract 5 g
NaCl 10 g
pH 7.2
加水至1000 mL(固体培养基加1.8%琼脂粉)
2) LB抗性筛选培养基
待灭菌后的LB固体培养基温度降至50℃左右,加入抗生素储存液卡那霉素(50 mg/mL)或羧苄青霉素(100 mg/mL)至终浓度50 µg/mL,即每毫升培养基加抗生素储存液1 µL,摇匀后,倒平板。
液体LB抗性筛选培养基,在完全冷却后加入抗生素,加入的量与固体培养基相同。
3) SOC液体培养基
Tryptone 20 g
Yeast Extract 5 g
NaCl 0.5 g
加入950 mL水,完全溶解后加入250 mmol/L的KCl溶液10 mL,用NaOH溶液(5 mmol/L)调节pH值至7.0,双蒸水定容至1000 mL后高压灭菌。灭菌后降温至60℃以下,加入7.2 mL 50%葡萄糖溶液。使用前加入5 mL经灭菌的2 mol/L的MgCl2溶液。
主要设备
1. MDF-192型超低温冰箱,日本三洋电机株式会社;
2. CF43S超净工作台,Gelman公司;
3. 高速冷冻台式离心机,Heraeus Sepatech公司;
4. Capsule HF-120型微量离心装置,Millipore公司;
5. BL150S型电子天平,德国Sartorius公司;
6. GB 1302型天平,Mettler-Toledo仪器(上海)有限公司
7. C-90-1型电热恒温水浴锅,广州市越秀区医疗器械厂;
8. 微波炉,日本Sharp;
9. YXQ.WY21-600IIR卧式高压蒸汽消毒器,广州市医疗设备厂;
10. DYCD-31D型水平电泳槽,北京六一仪器厂;
11. EPS1001型电泳电源,Amersham Pharmacia公司;
12. 连续可调微量移液器,德国Eppendorf公司;
13. Primus 25型PCR基因扩增仪,德国MWG公司;
14. AlphaImager 2200型凝胶图像分析系统,Alpha Innotech公司;
15. XK96-B微型旋涡混合仪,江苏省姜堰市新康仪器厂;
16. 细菌过滤器(0.2 µm孔径),美国Pall公司;
17. Model 1000 Hybidization incubator,美国Robbins Scientific公司;
18. 紫外交联仪Stratagene 1800,广州英韦创津有限公司;
19. Hybond N+尼龙膜;Amersham Biosciences公司;
20. Kodak X-OMAT AR胶片;
21. Watteman滤纸;
22. BIO-RAD Molecular Imager FX成像系统。
实验材料
1. 前期实验获得的昆虫病原线虫双链cDNA
2. 质粒与菌株
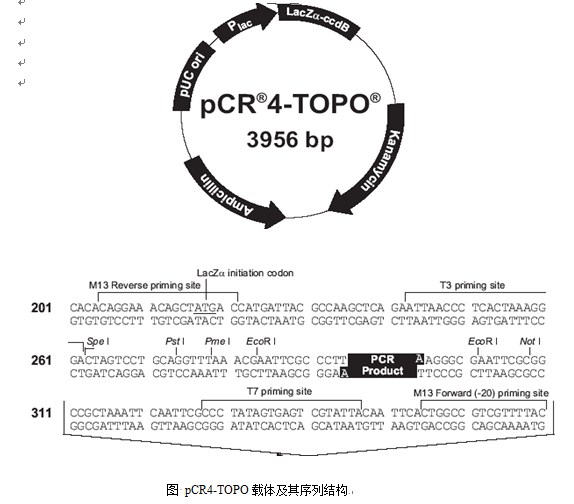
1) 线性克隆载体pCR4-TOPO,美国Invitrogen公司;
2) 大肠杆菌E. coli TOP10,美国Invitrogen公司。
实验步骤
1. 诱导过的感染期线虫cDNA文库的构建
1) PCR产物与载体的体外连接
克隆载体pCR4-TOPO是经过DNA拓扑异构酶(topoisomerase)活化的一种线性T载体,由于DNA拓扑异构酶能够特异性地解旋DNA超螺旋,同时对DNA特殊序列CCCTT特异性识别,在构建新载体的克隆技术中常被用于对外来目的基因片段的高效连接。经DNA拓扑异构酶活化后的线性DNA载体,在受到外来目的基因片段的“攻击”后,发生DNA链之间的重连反应,经过酶与双螺旋DNA的非共价结合、单链DNA断裂并与酶形成共价中间产物、单链脱离、断裂键的重连等过程后完成目的片段与供载体的连接。与此同时,拓扑异构酶从DNA上脱离。
由于线性载体5’末端带有T碱基,当使用Easy-A high fidelity cloning enzyme催化PCR反应时,即能保证扩增反应时的保真性,而且扩增产物的3’端会带有碱基A,这样可以将纯化的PCR产物直接用于与线性载体的连接,而无需传统的酶切、连接手段,具有省时,高效的优点。连接成功后,环化的克隆载体带有目的基因。同时,载体上的Kanr基因可用于携带目的片段的大肠杆菌重组子阳性克隆的抗性筛选,而复制起始子pUC使其保持在大肠杆菌TOP10中的高拷贝复制。
在洁净的0.2 mL PCR管中依次加入下列组分:
PCR产物 4 μL
盐溶液 1 µL
TOPO载体(pCR4-TOPO) 1 µL
总体积 6 µL
轻混反应物,室温(20℃~23℃)下培养10 min,取2 µL用于随后的转化实验或于-20℃保存备用。
2) 大肠杆菌的转化
A. 取出一管TOP10感受态细胞50 µL,于冰上缓慢旋转融化;
B. 加入2 µL待转化质粒(或不加质粒作阴性对照),轻轻旋转,将质粒与感受态细胞混合均匀,冰浴30 min;
C. 42℃热休克30秒,不要摇动离心管;
D. 立即将离心管转移到冰上,放置5 min,加入250 µL平衡到室温的无菌SOC培养基;
E. 拧紧瓶盖,于37℃,200 rpm水平振荡60 min;
F. 取10 µL~100 µL不同体积的菌液铺于预热的选择性LB平板上,37℃倒置培养过夜;
G. 转化子培养后,保存于15%甘油中,-80℃冻存。
3) 克隆片断长度的检测
从转化板上挑取转化子菌落,接种到650 μL LB抗性液体培养基中,37℃,200 rpm,培养过夜。吸取菌培养物作为PCR反应的模板,建立以下反应体系:
ddH2O | 17.35µL | ||
10×PCR buffer | 2.5 µL | ||
dNTP Mix (10 mmol/L) | 0.5 µL | ||
M13-for (1 µmol/L) | 2 µL | ||
M13-rev (1 µmol/L) | 2 µL | ||
DNA template | 0.5µL | ||
Taq DNA Polymerase | 0.15 µL | ||
Total volume | 50 µL |
利用pCR4-TOPO载体测序引物M13进行菌落PCR检测鉴定插入片断的长度,筛选大于400bp的克隆进行杂交实验。
充分混匀,按以下程序进行PCR扩增:95℃热变性5 min进入循环,94℃变性45秒,55℃退火45秒,72℃延伸1 min,30个循环后于72℃继续延伸10min。扩增产物以琼脂糖凝胶电泳检测,置于-20℃保存备用。
2. 探针模板的合成及探针的制备
1) 第一链cDNA探针模板的合成
参照SuperScriptTM II Reverse Transcriptate试剂盒说明书。
A.以提取的对照线虫的及共生细菌诱导线虫的总RNA合成探针模板。在1.5 mL离心管(无RNA酶)中,依次加入下述组分建立反应体系:
50ng~250 ng Radom primer | 1 µL | ||
5 µg Total RNA | .5µL/3.6µL | ||
1 µL dNTP Mix (10 mM each) | 1 µL | ||
ddH2O | 6.5µL /6.4µL | ||
Total volume | 12 µL |
B. 65℃温育5 min,立即到冰上冷却,微离,收集液体于管底,依次加入如下组分:
5×First-Strand Buffer | 4 µL | ||
0.1 M DTT | 2 uL | ||
RNaseOUTTM(40 units/µL) | 1 µL | ||
Total volume | 7 µL |
C. 充分混匀,室温放置2 min;
D. 加入1 μL(200 units)SurperscriptTM II RT,吸头混匀;
E. 42℃温育50 min;
F. 70℃,15 min终止反应;
G. 加入1 μL(2 units)E.coli RNase H,37℃温育20 min,以去除RNA;
2) 第一链cDNA 探针模板的纯化
A. 加入5倍体积的Buffer PB到上述产物中,充分混匀;
B. 取出样品收集管和吸附柱,将混合物全部转移到柱中,13000 rpm,离心1 min;
C. 取下吸附柱,弃去收集管中废液,将吸附柱套回同一支收集管中,吸取 0.75 mL Buffer PE到吸附柱中,高速离心1 min,弃滤过液;
D. 再次高速离心1 min,移走残留的洗液;
E. 将吸附柱套入干净的1.5 mL离心管中,在柱膜中央加入30 μL ddH2O,室温放置1 min,高速离心1 min,洗脱产物于-20℃保存备用。
3) 探针的制备
按照TaKaRa Random Primer DNA Labeling Kit Ver. 2.0说明书的方法。
A. 在0.2 mL PCR管中加入14 μL第一链cDNA,2 μL Random Primer,充分混匀;
B. 再依次加入下述组分建立反应体系:
10×Buffer | 2.5 µL | ||
dNTP Mixture(except dCTP) | 2.5 µL | ||
111 TBq/mmol(α-P32 dCTP) | 3 µL | ||
Exo-free Klenow Fragment | 1 μL | ||
Total volume | 25 µL |
C. 37℃反应10 min;
D. 65℃加热5 min使酶失活;
E. 95℃加热3 min后迅速置于冰中冷却;
F. 取适量的反应液直接作为探针使用。
3. 斑点杂交
1) PCR产物变性
在15 μL PCR产物中依次加入43 μL的ddH2O,40 μL 1M的MaOH(终浓度0.4M)和2 μL 0.5M的EDTA(终浓度0.01M),100℃热变性10 min,之后立即冰浴。
2) 制膜点样
采用Bio-Dot微过滤系统制膜点样,装置的安装及转膜操作按说明书进行。
A. 用6×SSC浸润Hybond-N 尼龙膜10 min;
B. 将膜用滤纸吸掉多余的SSC,置于微过滤装置上,对角线拧紧旋钮,打开调节开关,呈真空状态,并再次对角线旋紧旋钮;
C. 调节开关使之形成部分真空,各孔分别加入100 μL ddH2O,手动调节开关,形成部分-完全真空,慢慢滤干水;
D. 各孔加入45 μL变性后的DNA样品,按步骤(3)操作,慢慢滤干样品;
E. 各孔加入100 μL 2×SSC至各孔,调节开关至完全真空状态,直至各孔的样品完全转移到膜上;
F. 拧松螺旋,移走样品板,关闭真空泵,取下膜;
G. 在紫外交联仪(Stratagene 1800)中,DNA交联固定40秒;
H. 使膜夹于两层滤纸间,80℃加热30 min,然后用保鲜膜包好,4℃保存;
I. 清洗、晾干微过滤装置,同样的方法平行点另一张膜。
3) 杂交
A. 预杂交:将点好样的平行膜分别置于杂交管中,各加入5~10 mL杂交液,排尽气泡,65℃预杂交3 h;
B. 杂交:将标记好的两种探针25 μL,分别加到杂交液中,65℃杂交过夜。
C. 洗膜:将杂交液倒出,30℃用洗膜液I短暂淋洗;再用杂交液I洗膜10 min,1次;再用杂交液II洗膜10 min,1次;再用杂交液III洗膜5 min,1次;期间,不断用同位素检测仪检测,信号在10~20为佳,立即停止洗膜;
D. 洗完后的膜,用Watteman滤纸吸干膜上的水,保鲜膜包好,待放射自显影。
4) 放射自显影
A.将包裹好的尼龙膜置于已消磷的磷屏上,DNA面向着磷屏,室温放置一定时间(信号在5~10,压屏2h~3h;信号在20~50,压屏0.5h~1h;信号大于50,压屏20 min),将磷屏取出,放于分子磷屏成相系统FX(BIO-RAD)中扫描;
B. 根据信号的强弱,再将尼龙膜转入暗盒内,DNA面向着感光屏,再压上X光片(Kodak),置于-80℃,放射自显影3~7天;
C. 暗室内,先将紧靠感光屏的一张X光片浸入显影液中,显影30秒~90秒,期间可以在安全灯下观察而控制显影的时间,立即浸入定影液中1 min。同样方法,显影另一张X光片。将X光片用水冲洗干净,晾干。
4. 序列测定及同源性分析
挑取有差异的点的克隆的甘油贮存菌,委托北京三博远志生物有限公司测序。获得的序列分别使用BLASTn和BLASTx搜索National Center for Biotechnology Information (NCBI)的核苷酸和蛋白质数据库,进行序列的相似性分析。匹配性的P值为10-5或更小,我们认为序列之间有较高的相似性,否则认为序列的相似性很低,称为“low hits”,数据库中若没有与其匹配的序列称为“no hits”。
-
科技前沿