实验室pH测量原理与应用(七)
4. pH综合原理
在之前的章节中,已经讨论了pH测量的实际应用方面。此章节将主要介绍pH测量的理论知识,使读者基本理解pH测量的原理。首先,我们介绍一下pH理论的发展,然后了解电极的原理,最后再讨论几个特殊的主题。
4.1 pH值的定义
根据Sørenson的定义,pH为H3O+离子浓度的负对数:
pH = –log [H3O+]
从以上的公式可以看出,H3O+离子浓度每改变十倍,pH值改变一个单位。这很好阐明了测量出样品pH很小变化的重要性。
通常,pH理论描述为H+的浓度,但正确的应描述为水合氢离子H3O+(或根据IUPAC称为oxonium)
H+ + H2O ↔ H3O+
不但酸和碱能解离为水合氢离子或氢氧根离子,而且纯水也能解离为水合氢离子或氢氧根离子
2 H2O ↔ H3O+ + OH–
此过程的解离常数称为Kw,也称为水的自由离或自分解:
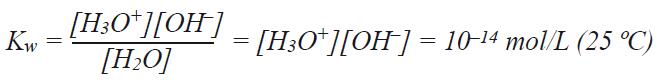
从Kw方程可以知道当H3O+和OH-总数相同的时候,溶液呈中性。即[H3O+]和[OH-]都为10-7mol/L时,pH值为7。当H3O+浓度更高时,pH值呈酸性范围,如H3O+浓度为10-3mol/L时([OH-] = 10-11 mol/L)pH值为3。
为了能测量样品的pH值,我们需知道pH电极如何对酸性溶液起作用。我们将在下一章节介绍。
4.2 浓度和活度的关联
我们已经讨论了pH值的数值决定于溶液中酸碱的浓度。事实上pH测量的为溶液中水合氢离子的活度。浓度仅仅在一些化学反应中,作为溶液活度的简称。
在许多情况下浓度非常的接近活度。
氢离子的活度(αH+)由氢离子的浓度和活度系数决定(γH+)。此时的浓度单位为质量摩尔浓度(b = mol/kg溶剂),而不是体积摩尔浓度(c = mol/L溶液),因为质量摩尔浓度是一个更明确的定义。
αH+ = γH+ · bH+
在稀溶液中,αH+≈bH+活度系数不是一个通用的系数,受到多种因素的影响,比如温度(T),总离子强度(I),导电常数,离子电荷(Z),离子的大小(埃)和介质的密度(d)。
有两点可以显著的影响离子活度和离子浓度的区别。所谓的盐度效应和介质效应。
溶液中盐的影响称为盐度效应,用γxH+表示。
公式为:

公式中的I指总离子强度1⁄2Σciz2i
如果假设pH测量时,阴离子和氢离子都是单价的,zi等于1,则总离子强度由质量摩尔浓度决定。盐度效应对离子活度系数的影响,已列在下表中(盐度效应与活度的关系)。
| 质量摩尔浓度 | 0.001 | 0.005 | 0.01 | 0.05 | 0.1 |
| 活度系数 | 0.967294 | 0.935044 | 0.915247 | 0.857205 | 0.829586 |
当比较测量含盐与不含盐的0.01 mol/L HCl时,可得到以下的对照:
| 0.01 mol/L HCl溶液: | 0.01 mol/L HCl 溶液含0.09 mol/L KCl: |
pH = –log (bH+ · γxH+) = –log(0.01×0.915) = –log(9.15×10-3) = 2.04 | pH = –log (bH+ · γxH+) = –log(0.01×0.829) = –log(0.829×10-3) = 2.08 |
从以上的例子可以看出离子浓度高的溶液pH值增加了0.04(氢离子的活度降低了)。这可以解释为什么同样酸含量而离子浓度不同的溶液会有不同的pH值。
第二个影响活度与浓度关系的是介质效应。介质效应定义为:
γmH+
这个影响介质(溶剂)的效应会影响H+活度。此效应中的静电和化学相互作用起到很大的作用。例如,水中的氢离子活度是乙醇溶液中氢离子活度的200倍。
当同时考虑到盐度效应和介质效应,浓度与活度的关系为:
αH+ = γxH+ · γmH+ · bH+
从这个例子中可以看出,了解测量样品的详细性质非常重要。只有在具体的测量环境下,才能得到良好的重复性。
4.3 缓冲溶液
缓冲溶液是pH精确测量的重要构成。标准缓冲液能校准电极和检测电极的性能。就如它的名字,缓冲液最重要的特性是它的缓冲能力。这个特性保证了即使外部物质进入pH缓冲液,缓冲液也能维持恒定的pH值。
缓冲液的缓冲能力由弱酸部分解离的能力所决定,产生以下平衡反应:
HA ↔ H+ + A-
在此平衡中,阴离子A-因为能接受系统中的质子,作为碱性物质。而未解离的弱酸HA,则可为系统提供质子。
平衡式中的缓冲液拥有足量的阴离子(A-),可以接受大量的加入系统中的质子,同时也拥有足量的未解离的酸,可以补充系统中失去的质子。由于未解离的酸HA可以视为H+的提供者,解离的A-作为H+的接受者,所以当HA和A-浓度相同时,缓冲液拥有最大的缓冲能力。
如果仔细探究缓冲液的原理,就能发现什么特性的溶液才能作为缓冲液。这些特性包括缓冲能力,温度影响,和稀释缓冲液后pH变化的大小。这些特性在许多缓冲液瓶上都有书面注明。




















