清华李艳梅&中科院深圳先进院喻学锋Biomaterials
黑磷纳米片作为免疫增强纳米佐剂及其近红外光促进的免疫治疗
【引言】肿瘤免疫治疗利用患者的免疫系统杀伤或根除肿瘤,是克服癌症转移和复发的重要临床手段。作为近年来快速发展的一种主动型疗法,治疗性癌症疫苗通过整合抗原和免疫佐剂,有望增强抗原免疫原性,并协调先天和适应性免疫系统产生肿瘤特异性应答。利用纳米体系调控疫苗的生理命运提高了免疫应答的方向性和精确性,发展更为有效和可控的治疗方法,如纳米疫苗设计与应用。而纳米材料的井喷式发展促进了相关疫苗体系设计的多样性和复杂性,有助于改进疫苗安全性和效力。不仅如此,一些纳米材料与体内免疫系统相互作用后会诱发免疫激活效应,如提高抗原呈递细胞(APC)的成熟、活化以及抗原展示等,这进一步促进了基于纳米材料所固有的免疫性质开发与应用,如纳米佐剂。尽管一些研究报道了纳米材料的佐剂性质和应用前景,但是人们仍然渴求一种集强大的佐剂性、优异的生物相容性、生物降解性和多种免疫增强机制于一体的理想型佐剂,其有望进一步扩充并优化相关免疫治疗。【成果简介】近日,在清华大学李艳梅教授和中科院深圳先进技术研究院喻学锋研究员带领下,研究团队深入研究了黑磷纳米片(BPs)的纳米佐剂性质和治疗应用前景。团队筛选得到的苯丙氨酸-赖氨酸-苯丙氨酸(FKF)片段可提升其共价修饰的抗原肽(OVAp)与BP的高效负载。其组装复合物FKF-OVAp@BP构成了一种极简的疫苗体系,无需添加额外组分,BP能够增强树突细胞(DC)的成熟、抗原摄取-释放-抗原呈递以及淋巴运输。系统性皮下免疫可显著增强小鼠脾脏与肿瘤内的抗原特异性CD8+
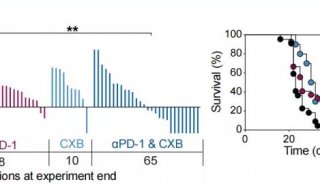
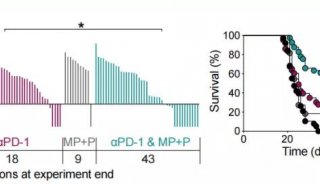
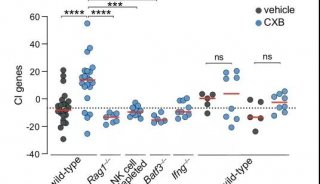
T细胞的活化与杀伤,进一步抑制肿瘤生长并延长小鼠存活率。瘤内原位免疫同样能够产生特异性的抗肿瘤应答;同时,BP的高效光热转化性质可实现近红外(NIR)介导的原位温和热生成,促进肿瘤免疫抑制微环境的改善,如提高活化DC的比例和增强T细胞效应性等。此外,光热促进下的瘤内原位免疫也大大提高了脾脏中记忆细胞应答,促进了长效的免疫监查。NIR促进的BP纳米疫苗进一步协同免疫检查点阻断疗法(anti-PD-L1单抗)实现强力的治疗作用,具有重要的临床应用价值。该工作探究了整合型、多功能化纳米佐剂材料可用于简化但高效的纳米免疫治疗,为之后的纳米佐剂拓展提供了重要基础和合理方案。该成果以题为“Black phosphorous nanosheet: A novel immune-potentiating nanoadjuvant for near-infrared-improved immunotherapy”发表在生物材料领域顶级期刊Biomaterials上。论文第一作者为清华大学化学系的博士生李文浩。
-
焦点事件