银染实验用水指南
SDS聚丙烯酰胺凝胶染色是蛋白质研究的一个基础方法。染色方法有很多,实际应用中,考马斯亮蓝染色(考染)和银染是运用的最多的方法。
考马斯亮蓝G250在游离状态下呈红色,它与蛋白质结合后变为蓝色,结合物在595 nm波长下有最大光吸收。其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。
银染实验中,在碱性条件下,银离子被还原成金属银,沉淀在蛋白质的表面上显色。蛋白电泳后的 SDS-聚丙烯酰胺凝胶在甲醇溶液中浸泡后,水洗后用硝酸银溶液银染,再水洗后用碳酸钠甲醇水溶液显色。
与考染相比,银染具有灵敏度高的优点,很多做环境、植物、育种等方面的客户,都会做银染方面的实验。银染对于试剂的要求比较高,尤其对其中使用纯水的水质要求比较高。上海乐枫(RephiLe)技术人员根据自身经验以及相关文献中的方法为用户提出以下银染实验方案:
一、仪器和试剂
乙酸(1%),显影液(2.5%碳酸钠和0.02%甲醛水溶液),乙醇(30%),固定液(乙醇:冰醋酸:水(30:10:60)),硝酸银溶液(0.1%),显影液(将溶液A在850 mL去离子水中加入37 g NaCl和37 g CuSO4,再加入浓氨水直到深蓝色沉淀形成然后溶解,定容至1 L)和溶液B(在900 mL去离子水中加入436 g 硫代硫酸钠,定容至1 L)混合,加三倍水稀释,立即使用
二、试验方法
1. 通过SDS-聚丙烯酰胺凝胶电泳分离蛋白质;
2. 将凝胶浸泡在至少5倍体积的固定液中,室温下平缓摇动4 - 12 h,使蛋白固定;
3. 弃去固定液,加至少5倍体积的30%乙醇,室温下平缓摇动30 min;
4. 重复步骤3;
5. 弃去乙醇,加10倍体积的纯水(去离子水),室温下平缓摇动10 min;
6. 重复步骤5两次;
7. 弃去清洗用水,加5倍体积的硝酸银溶液,室温下平缓摇动30 min;
8. 弃去硝酸银溶液,用纯水(去离子水)漂洗凝胶两面,每面20 s;
9. 加5倍体积的新鲜显影液,室温下平缓摇动,数分钟内出现蛋白质的染色条带,继续至条带清晰;
10. 用1%乙酸清洗凝胶终止反应,再用纯水(去离子水)水漂洗数次,每次10 min。
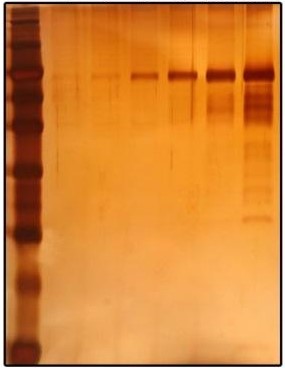
银染后的凝胶可以通过凝胶成像系统或扫描仪转化为照片,或者可以直接用手机拍摄。
在银染实验中,纯水(去离子水)水质非常重要,对实验成功与否起着关键性的作用。有用户在实验中忽略了这一点,纯水水质不佳,氯离子含量超标,浸泡时出现氯化银沉淀,覆盖在胶上,显影时看到的是一片花花的乱象,影响染色效果。
通常情况下,氯化银的溶解度通常是2 ppm。氯离子是水中常见的一种离子杂质,如果水中的氯离子超过2 ppm,即会产生沉淀杂质,也就是说,银染实验,对于纯水水质的要求是比较苛刻的,一般的反渗透纯水(RO)设备,对离子污染物的去除能力有限,还难以达到要求。
另外,水中的颗粒物也会吸附银离子后显色,污染背景,甚至让好好的凝胶成了“大花脸”。因此制备出来的纯水在使用前,还应该通过0.22或0.45μm的过滤器预先过滤,以去除水中的颗粒物。
专业来讲,银染用水应该尽量选用符合国标《分析实验室用水规格和试验方法》(GB/T 6682-2008)(参考链接 http://rephile.com.cn/web/news-1686465.html)二级纯水以上的水——电导率至少应当在 1 μS/cm以下。因此,银染用水应当使用EDI纯水或者超纯水,而RO 纯水是不能满足银染用水需求。




















