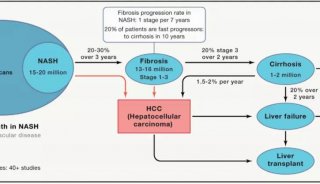
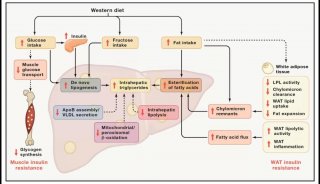
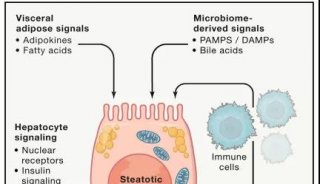
Koebnerisin:玫瑰痤疮发病机制中的新角色
S100蛋白家族是小的(9-13 kDa)钙结合分子,参与调控细胞信号、代谢和增殖。S100蛋白家族的一员,koebnerisin (S100A15),是一种天然抗菌肽,具有多种促炎功能,由位于1q21染色体上的表皮分化复合体中的基因编码。S100A15基因被转录成两个交替的mRNA剪接变体,短(S100A15 -S)和长(S100A15-L)亚型,它们具有相同的编码区域,但受到不同的调控[2]。Koebnerisin已被证明是一种预警蛋白,或具有危险相关分子模式(DAMP)。在应对一些内源性或外源性刺激时,koebnerisin增强皮肤免疫介导的炎症过程[2-4]。Koebnerisin在银屑病皮损中首次被发现是上调的,然而,它似乎也在其他慢性炎症性皮肤病中发挥了重要作用,如寻常痤疮[2,5]。在有炎症的皮肤中,koebnerisin由多种细胞表达,如角质形成细胞、成纤维细胞、内皮细胞和树突状细胞。koebnerisin在玫瑰痤疮中的作用尚未被研究。本研究的目的是探讨koebnerisin在玫瑰痤疮中的表达及功能。
研究对象包括中度和重度玫瑰痤疮患者(n=6)。皮肤活检取自位于面部的炎症性、红斑脓疱性皮损。所有患者均为白种人,皮肤类型为I-III型,年龄47-66岁(平均±标准差 56.83±7.03)。对照组由接受面部整形手术的健康志愿者组成,按种族、性别、年龄进行配对(n=6)。采用逆转录实时定量PCR和免疫荧光分析法检测玫瑰痤疮患者和对照组皮损中koebnerisin的表达情况。采用逆转录实时定量PCR技术,研究了koebnerisin在玫瑰痤疮相关的人皮肤细胞培养、角质形成细胞和成纤维细胞中的调控作用。
在本研究中,我们发现,与健康皮肤相比,玫瑰痤疮皮损中koebnerisin表达上调(图1)。koebnerisin在表皮细胞、基底细胞和真皮细胞均有高表达。表皮中koebnerisin的上调提示其在调节角质形成细胞增殖和功能中的潜在作用。此外,在玫瑰痤疮皮损中过表达,提示koebnerisin可能具有促炎作用。之前有研究表明,koebnerisin是单核细胞和中性粒细胞的趋化剂,在玫瑰痤疮的发病过程中起重要作用[3]。此外,已经证明,koebnerisin主要作用于角质形成细胞和白细胞,促进促炎细胞因子的产生,如肿瘤坏死因子(TNF-α)、白细胞介素(IL) 6、IL-8和IL-1[4,6]。最近的研究表明TNF-α和IL-1在玫瑰痤疮中起重要作用[1]。我们还发现TNF-α增强了角质形成细胞和成纤维细胞中koebnerisin的表达(Fig 2, A and B),这可能导致恶性炎症环路的产生。在本研究中,我们还发现,koebnerisin可能通过刺激角质形成细胞和成纤维细胞,促进血管生成介质血管内皮生长因子的产生,从而发挥额外的促血管生成作用。我们进一步证明,koebnerisin促进成纤维细胞增加基质金属蛋白酶9的表达(图2, C-F )。基质金属蛋白酶9对真皮成分具有破坏作用,从而促进天然免疫反应和炎症过程。
图1. Koebnerisin在中、重度玫瑰痤疮患者皮损中均有过表达。A, 逆转录实时定量PCR。与健康人皮肤相比,玫瑰痤疮皮损中koebnerisin亚型(S100A15S)表达增加。数据用平均值±标准误差表示。B, 免疫荧光染色。与健康人皮肤相比,玫瑰痤疮皮损中koebnerisin表达增加。 *P=0.0087

图2. 逆转录实时定量PCR检测正常人皮肤和中、重度玫瑰痤疮患者皮肤的mRNA表达。A和B, Koebnerisin (S100A15) 增强VEGF的表达,不影响人角质形成细胞中MMP-9的表达。C和D,Koebnerisin能增强VEGF和MMP-9在人成纤维细胞中的表达。E, TNF-α和IL-17A增强了人角质形成细胞中koebnerisin的表达。F, TNF-α增强了人成纤维细胞中koebnerisin的表达。数据用平均值±标准误差表示。*P=.05. IL-17A, 白介素17A; MMP-9,基质金属蛋白酶-9; TNF-α, 肿瘤坏死因子α; VEGF, 血管内皮生长因子
综上所述,koebnerisin (S100A15)可能成为玫瑰痤疮发病机制中的一个新角色。平衡某些抗菌蛋白的活性可能是未来治疗玫瑰痤疮的一个靶点。
-
项目成果