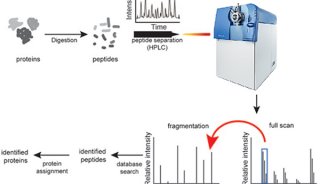
西北大学团队的“top-down”质谱法每天可分析上千个单细胞
西北大学研究团队开发出一种基于电荷检测质谱技术的自顶向下(top-down)的单细胞蛋白质组学方法。该方法在本月发表于BioRxiv预印本上,科学家们用此方法可以每天检测1000多个单细胞中的完整蛋白质。虽然该技术的开发仍处于早期阶段,但是西北大学生命过程化学研究所主任、论文的通讯作者Neil Kelleher表示,他和他的同事们希望在几年内能够与大规模自顶向下蛋白质组学分析取得同等水平。
该方法采用了Kelleher及其共同作者去年在Science Advances上发表的蛋白质变体成像质谱(PiMS)方法,他们使用了一种称为单个离子质谱(I2MS)的基于电荷检测质谱技术,使研究人员能够逐个分析离子,减少了产生的信号的复杂性。研究人员利用这项技术进行了自顶向下的质谱成像。传统上,这样的成像实验局限于相对较小的蛋白质变体,但是I²MS所具有的分离质谱成像产生的复杂离子混合物的能力使得Kelleher及其同事能够显著扩展他们所能处理的蛋白质变体质量范围。他们将I2MS与环境纳米喷雾解吸电喷雾离子化技术(nano-DESI)结合起来对人类肾脏组织成像,鉴定了169种质量高达70 kDa的蛋白质变体。
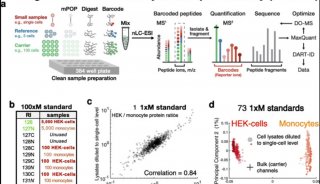
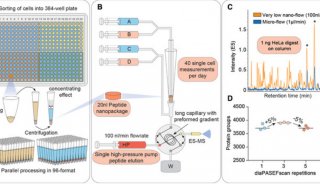
在他们最近的预印本中,Kelleher及其同事将这种技术应用于单细胞的高通量分析。研究人员从大鼠海马体中取出细胞并将其滴在玻片上。然后,如他们所述,他们扫描玻璃片上的“液滴”,同时不断使用纳米DESI源对液滴进行采样。当液滴接触到玻片上的一个细胞时,离子源对细胞内容物离子化,产生蛋白质变体离子,这些离子被引入质谱仪并通过I²MS分析。
使用这种方法,研究人员能够在大鼠脑细胞中识别出169种蛋白质变体。他们还表明,可以根据所含蛋白质变体将分析的一部分细胞分类为神经元、星形胶质细胞或小胶质细胞。此外,由于该方法不使用液相色谱分离,而是直接将样本引入质谱仪,因此具有非常高的通量。预印本中使用的工作流程能够每小时分析约80个细胞。在10天的研究中,研究人员总共分析了10,836个单细胞。
预印本中所展示的研究主要是原理验证,仍需要进行大量的开发工作,但Kelleher表示,这为高通量收集单细胞自顶向下蛋白质组学数据提供了一种途径。
自顶向下蛋白质组学很有吸引力,因为通过分析完整的蛋白质,而不是像自底向上蛋白质组学中那样消化成肽段,研究人员可以更好地观察剪切变异、截断和翻译后修饰等在生物过程中起关键作用的特征。
通量是蛋白质组学的一个重要问题,特别是单细胞蛋白质组学需要大量的细胞数据以进行稳健分析,每个细胞构成其自己的质谱实验。从这个角度,能够每天分析1,000个以上的单细胞是一大福音。“这非常大胆和令人兴奋,”东北大学生物工程副教授、单细胞蛋白质组学的先驱尼古拉伊·斯拉沃夫(Nikolai Slavov)对Kelleher实验室的自顶向下单细胞研究表示赞赏,“单位时间分析的单细胞数量非常高。”他还指出,收集蛋白质变体信息的能力很重要。“显然,我们都想知道蛋白质变体,当我们进行自底向上分析时,我们对蛋白质变体的认识是间接的,”他说,“完整蛋白质分析使我们可以直接测量真正想知道的内容。”虽然没有参与预印本工作,但斯拉沃夫指出,该技术目前还不能产生太多的定量信息,这是Kelleher所承认的一个缺陷。
“定量很难,”Kelleher评论道,在这方面的主要困难之一是引入足够的离子进入质谱仪以进行良好的定量分析。斯拉沃夫指出,当只有少数蛋白质变体离子成功进入质谱仪时,背景噪音会使其难以准确定量。他说:“解决这个问题主要需要提高离子化效率和传输效率。”,“我认为这是未来发展的一个非常重要的方向。”
“我们知道我们没有得到好的(离子)提取。只有一小部分蛋白质变体从细胞中释放出来。平均每个细胞只得到约10,000个离子,”Kelleher说,“我们团队的初步重点是展示这种技术的通量”。他列举了单细胞RNA测序的例子,表示相信离子提取和定量分析能力可得以显著提升。他说:“单细胞RNA测序的早期是在2012年、2014年,然后到了2016年,你就可以在一个单细胞中获得2,000到3,000个转录本。我们将经历同样的成熟曲线。我希望在三到四年的时间内达到我们可以在大规模(自顶向下分析)中实现的深度。”
最近的大规模自顶向下的研究确定了2,000到3,000种蛋白质和20,000到30,000种蛋白质变体,其中约1,000到2,000种蛋白变体可被重复定量。
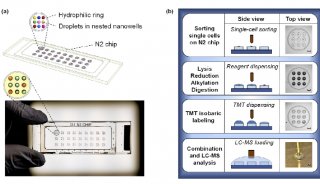
自底向上的单细胞蛋白质组学流程也在不断发展。在本月在休斯顿举行的美国质谱学会年会上,Bruker突出了其新的timsTOF Ultra仪器在单细胞蛋白质组学方面的能力,在新闻材料中指出该仪器可以在单个细胞水平上识别约5,000种蛋白质,并以<20%的变异系数对超过4,800种蛋白质进行定量分析。此外,维也纳分子病理学研究所的蛋白质组学主管卡尔·梅赫特勒在本周的Bruker用户会议上展示了他的实验室使用Ultra仪器生成的数据。他的实验室使用该系统观察单个HeLa和K562细胞时,分别识别了3,803和3,221种蛋白质。
在通量方面,斯拉沃夫及其同事继续开发他们的plexDIA方法,该方法将非同位素质量标记与数据独立获取质谱相结合,以实现在短的液相色谱梯度上运行多重单细胞质谱实验。迄今为止,研究人员已经发表了一种结合三重标记和五分钟液相色谱梯度的版本,但斯拉沃夫表示,他相信多重性水平可以增加到20个,而色谱运行时间也可以大大缩短,可能降至一分钟左右。
参考文献:
[1] Top-down Proteomics of 10,000 Single Brain Cells. Pei Su, Michael A. R. Hollas, Stanislav Rubakhin, Fatma Ayaloglu Butun, Joseph B. Greer, Bryan P. Early, Ryan T. Fellers, Michael A. Caldwell, Jonathan V. Sweedler, Jared O. Kafader, Neil L. Kelleher bioRxiv 2023.05.31.543176; doi: https://doi.org/10.1101/2023.05.31.543176.
-
焦点事件

-
招标采购

-
精英视角

-
企业风采

-
综述
-
焦点事件
-
会议会展