上科大两篇Cell 聚焦抗结核病药物靶点与人源大麻素受体
第一部分:
肺结核病目前仍然是全球人类健康的首要威胁之一。分枝杆菌是引起人类多种严重疾病的病原菌,包括结核病(TB)、麻风病、复合菌群布鲁里溃疡和肺非结核分枝杆菌病【1】。仅在2017年,估计就有1000万新结核病例被诊断和130万死亡病例出现。这使它成为导致人类死亡的主要传染病之一。此外,多重耐药和完全耐药的结核分枝杆菌的出现,使它成为极其难以治愈的疾病【2, 3】。因此,发现新的TB药物靶点是科学家们梦寐以求的事。
MmpL(Mycobacterial membrane protein Large)是分枝杆菌基因组编码的一组膜蛋白,属于抵抗、结瘤和分裂(RND)蛋白家族【4】。在革兰氏阴性菌中,RND转运蛋白(包括MmpL蛋白)分子能主动向胞外排出多种抗生素,因此在细菌耐药中发挥重要作用【4, 5】。结核分枝杆菌(M. tuberculosis, Mtb)编码13种MmpL蛋白,MmpL3、4、5、7、8、10和11已被报道参与分枝杆菌细胞膜的生物合成【6】。
MmpL3是其中唯一被认为是细菌(包括Mtb)细胞复制和存活必不可少的分子。实际上,下调MmpL3的表达,阻止细胞分裂并导致细胞迅速死亡【7】。MmpL3的序列在分歧杆菌和棒状杆菌中是高度保守的,参与霉菌酸的运输【8】。霉菌酸是分枝杆菌细胞外膜的关键成分,并对分枝杆菌的生长必不可少,导致脂质双分子层的完全疏水和外源化合物的不可透过性,其中包括多种抗生素【9】。MmpL3的失活抑制了分枝杆菌中分枝酸合成的关键步骤。
目前已经开发的MmpL3抑制剂有二元胺、吲哚甲酰胺、二苯吡咯、金刚烷基脲类、和螺环。其中,二元胺中SQ109,作为抗结核药目前处于临床二期研究阶段。它能很有效地抑制各种Mtb菌株,甚至包括临床耐药菌株。体外细菌对SQ109的变异率非常低,表明对这种化合物的抗性发展会非常慢【10】。此外,细胞水平的实验表明,SQ109和其他药物共同使用还具有协调效应。这也再次筝码MmpL3作为药物靶点的重要性。
但是,由于膜蛋白结构解析的难度比较大,目前关于MmpL家族蛋白的结构生物学信息非常有限。唯一被解析的结构是MmpL11的一个PC亚结构域(D2),只有88个氨基酸残基的胞质部分片段【11】。
1月24日,上海科技大学iHuman研究所饶子和院士与杨海涛教授的合作团队在Cell上发表了题为Crystal Structures of Membrane Transporter MmpL3, an Anti-TB Drug Target的研究论文,文中解析了结核分枝杆菌(M . smegmatis)MmpL3完整的晶体结构以及和四个潜在药物形成的复合物的晶体结构。MmpL3结构的解析,对促进MmpL3的抑制剂的筛选以及抗结核病药物的研究具有极其重要的意义。

提到耻垢分枝杆菌(Mycobacterium Smegmatis),此前BioArt也报道过饶子和院士团队2018年10月份发表在Science上的题为An electron transfer path connects subunits of a mycobacterial respiratory supercomplex的文章【12】(Science丨立足抗结核病药物靶点开发,饶子和院士团队历时多年解析分歧杆菌呼吸体超复合物III2IV2SOD2原子分辨率结构)。文中解析了耻垢分枝杆菌呼吸体超复合物III2IV2SOD2原子分辨率冷冻电镜结构。
M . smegmatis是一种过氧化氢耐受株。与结核分枝杆菌(M.tuberculosi)比较接近,同属分枝杆菌属。耻垢分枝杆菌相对结核杆菌操作安全性要好的多,因此可作为研究结核杆菌的理想替代研究对象。饶子和院士团队多年来专注于分枝杆菌编码的关键蛋白分子的结构生物学研究,此次解析的重要膜蛋白分子MmpL3的晶体结构,也是多年来厚积薄发的结果。

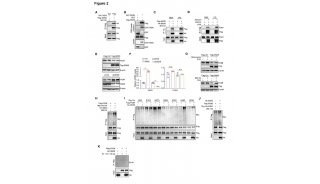
图1. Mycobacterium smegmatis编码的MmpL3的整体结构
文中首先解析了单独的MmpL3分子的晶体结构(图1)。MmpL3的总体结构图中,PN和PC结构域是它的胞外可溶区,这部分被称为胞质孔状结构域。TMN和TMC共包含12个跨膜螺旋,它们被称为跨膜区结构域。
胞质孔状结构域中,PN和PC都由β-α-β-α-β折叠组成,这一结构特点在MmpL 11的D2结构域(PC)【11】和AcrB的孔状结构域(PN1,PN2,PC1和PC2)中也存在【13】。PN和PC交织在一起,中间形成一个空腔,右侧图更形象地将其显示为灰色的表面电势图。这个空腔连接GT、GF和GB三个开口,这几个开口处都有亲水的氨基酸把守着,能够允许特定的分子进出。
跨膜区结构域中,TMH IV和TMH X构成跨膜螺旋束的核心区域。在这两个螺旋之间,有两对亲水残基(Asp256-Tyr646和Asp645-Tyr257),它们之间能形成氢键来连接两个螺旋。这两对亲水残基在 MmpL家族中是保守的(MmpL7除外)【14】。已经有报道过的类似的三联氨基酸Asp-Asp-Lys位于AcrB;三联氨基酸Asp-Asp-Thr位于SecDF。这两个三联氨基酸都参与质子传递路径【15-17】。值得注意的是,Asp-Tyr双突变的MmpL3能够使分枝杆菌在培养基中停止生长分裂【14】。这一结论和MmpL在质子传递中的重要作用具有一致性。
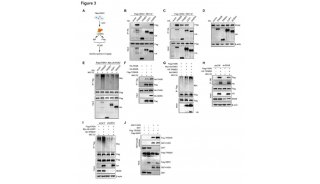
随后,文章中通过MST(microscale thermophoresis,微量热泳动)实验验证MmpL3及其突变体对抑制剂的结合强弱。结论是SQ109、AU1235、ICA38及 rimonabant与MmpL3的解离常数分别是是1.65 uM,0.003 uM,0.16 uM和29 uM。

图2. MmpL3及其突变体对潜在药物分子的抗性和药物敏感性分析
确定了这些分子能和MmpL3的结合之后,进一步分别解析了MmpL3和四种抑制剂药物的复合物的晶体结构。并对药物结合口袋进行了分析(图3)。图中洋红色(图3B),绿色(图3C),橘色(图3D)和黄色(图3E)的药物分子分别对应SQ109、AU1235、ICA38和 rimonabant。它们都结合在质子传送通道中,文中对这个结合口袋进行了精细分区,分为S1-S5五个亚区。其中,SQ109、AU1235和ICA38结合模式相似,占据了S3-S5三个亚区,而rimonabant跟其它上分子相比比较特殊,它的额外的两个基团还占据了S1和S2亚区。这种药物结合的结构特点,对于抑制MmpL3这一靶点蛋白的抗结核药物设计具有非常重要的指导作用。

图3. MmpL3的抑制剂结合口袋分析及其对药物设计的指导作用
第二部分:
上海科技大学iHuman研究所刘志杰教授课题组长期聚焦大麻素受体的系统性研究,试图理解其调控的重要生理功能和其结构基础。目前他们已分别发表了CB1与拮抗剂AM6538复合物的晶体结构(Cell, 2016)、CB1分别与激动剂AM841及AM11542复合物的晶体结构(Nature, 2017)。在前期工作的基础上,为攻克CB2受体结构及调控机制,刘志杰团队与美国东北大学的Alexandros Makriyannis教授团队合作并设计了CB2的新型拮抗剂AM10257。研究团队通过理性突变位点预测和大量实验筛选,最终获得了高质量的CB2蛋白样品并成功解析了CB2与AM10257复合物2.8埃分辨率的晶体结构。相关工作以Crystal Structure of the Human Cannabinoid Receptor CB2为题于2019年1月11日在线发表于Cell杂志上,该论文1月24与饶子和院士团队的Cell论文同时正式出版。

附近三年上海科技大学iHuman研究所发表的部分代表性论文:
1、Li, X., Hua, T., Vemuri, K., Ho, J. H., Wu, Y., Wu, L., ... & Liu, Z. (2019). Crystal Structure of the Human Cannabinoid Receptor CB2. Cell.
2、Zhang, B.,........ & Rao, Z. (2019). Crystal Structures of Membrane Transporter MmpL3, an Anti-TB Drug Target. Cell
3、Peng, Y., McCorvy, J. D., Harpsøe, K., Lansu, K., Yuan, S., Popov, P., ... & Liu, Z. (2018). 5-HT2C receptor structures reveal the structural basis of GPCR polypharmacology. Cell, 172(4), 719-730.
4、Yang, S., Wu, Y., Xu, T. H., de Waal, P. W., He, Y., Pu, M., ... & Zhao, S. (2018). Crystal structure of the Frizzled 4 receptor in a ligand-free state. Nature, 560(7720), 666.
5、Song, G., Yang, D., Wang, Y., de Graaf, C., Zhou, Q., Jiang, S., ... & Liu, Z. (2017). Human GLP-1 receptor transmembrane domain structure in complex with allosteric modulators. Nature, 546(7657), 312.
6、Hua, T., Vemuri, K., Nikas, S. P., Laprairie, R. B., Wu, Y., Qu, L., ... & Liu, Z. (2017). Crystal structures of agonist-bound human cannabinoid receptor CB 1. Nature, 547(7664), 468.
7、Hua, T., Vemuri, K., Pu, M., Qu, L., Han, G. W., Wu, Y., ... & Liu Z. (2016). Crystal structure of the human cannabinoid receptor CB 1. Cell, 167(3), 750-762.
注:部分内容引自上海科技大学iHuman研究所官方微信号。
参考文献
1. Forbes, B.A., Hall, G.S., Miller, M.B., Novak, S.M., Rowlinson, M.C., Salfinger, M., Somosko vi, A., Warshauer, D.M., and Wilson, M.L. (2018). Practice Guidelines for Clinical Microbiology Laboratories: Mycobacteria. Clin. Microbiol. Rev. 31, 31.
2. Gandhi, N.R., Nunn, P., Dheda, K., Schaaf, H.S., Zignol, M., van Soolingen, D., Jensen, P., and Bayona, J. (2010). ultidrug-resistant and extensively drug resistant tuberculosis: a threat to global control of tuberculosis. Lancet 375, 1830–1843.
3. Udwadia, Z.F., Amale, R.A., Ajbani, K.K., and Rodrigues, C. (2012). Totally drug-resistant tuberculosis in India. Clin. Infect. Dis. 54, 579–581.
4. Viljoen, A., Dubois, V., Girard-Misguich, F., Blaise, M., Herrmann, J.L., and Kremer, L. (2017). The diverse family of MmpL transporters in mycobacteria: from regulation to antimicrobial developments. Mol. Microbiol. 104, 889–904.
5. Blair, J.M., Richmond, G.E., and Piddock, L.J. (2014). Multidrug efflux pumps in Gram-negative bacteria and their role in antibiotic resistance. Future Microbiol. 9, 1165–1177.
6. Sze´ kely, R., and Cole, S.T. (2016). Mechanistic insight into mycobacterial MmpL protein function. Mol. Microbiol. 99, 831–834.
7. Degiacomi, G., Benjak, A., Madacki, J., Boldrin, F., Provvedi, R., Palu` , G., Kordulakova, J., Cole, S.T., and Manganelli, R. (2017). Essentiality of mmpL3 and impact of its silencing on Mycobacterium tuberculosis gene expression. Sci. Rep. 7, 43495.
8. Varela, C., Rittmann, D., Singh, A., Krumbach, K., Bhatt, K., Eggeling, L., Besra, G.S., and Bhatt, A. (2012). MmpL genes are associated with mycolic acid metabolism in mycobacteria and corynebacteria. Chem. Biol. 19, 498–506.
9. Jankute, M., Cox, J.A., Harrison, J., and Besra, G.S. (2015). Assembly of the Mycobacterial Cell Wall. Annu. Rev. Microbiol. 69, 405–423.
10. Sacksteder, K.A., Protopopova, M., Barry, C.E., 3rd, Andries, K., and Nacy, C.A. (2012). Discovery and development of SQ109: a new antitubercular drug with a novel mechanism of action. Future Microbiol. 7, 823–837.
11. Chim, N., Torres, R., Liu, Y., Capri, J., Batot, G., Whitelegge, J.P., and Goulding, C.W. (2015). The Structure and Interactions of Periplasmic Domains of Crucial MmpL Membrane Proteins from Mycobacterium tuberculosis. Chem. Biol. 22, 1098–1107.
12. Hongri Gong, Jun Li, Ao Xu, Yanting Tang, Wenxin Ji, Ruogu Gao, Shuhui Wang, Lu Yu, Changlin Tian, Jingwen Li, Hsin-Yung Yen, Sin Man Lam, Guanghou Shui, Xiuna Yang, Yuna Sun, Xuemei Li, Minze Jia, Cheng Yang, Biao Jiang, Zhiyong Lou, Carol V. Robinson, Luet-LokWong, LukeW. Guddat, Fei Sun, QuanWang, ZiheRao. (2018) . An electron transfer path connects subunits of a mycobacterial respiratory supercomplex. Science, 362(6418)
13. Murakami, S., Nakashima, R., Yamashita, E., and Yamaguchi, A. (2002). Crystal structure of bacterial multidrug efflux transporter AcrB. Nature 419, 587–593.
14. Bernut, A., Viljoen, A., Dupont, C., Sapriel, G., Blaise, M., Bouchier, C., Brosch, R., de Chastellier, C., Herrmann, J.L., and Kremer, L. (2016). Insights into the smooth-to-rough transitioning in Mycobacterium bolletii unravels a functional Tyr residue conserved in all mycobacterial MmpL family members. Mol. Microbiol. 99, 866–883.
15. Eicher, T., Seeger, M.A., Anselmi, C., Zhou, W., Brandsta¨ tter, L., Verrey, F., Diederichs, K., Faraldo-Go´ mez, J.D., and Pos, K.M. (2014). Coupling of remote alternating-access transport mechanisms for protons and substrates in the multidrug efflux pump AcrB. eLife 3, 3.
16. Murakami, S., Nakashima, R., Yamashita, E., Matsumoto, T., and Yamaguchi, A. (2006). Crystal structures of a multidrug transporter reveal a functionally rotating mechanism. Nature 443, 173–179.
17. Tsukazaki, T., Mori, H., Echizen, Y., Ishitani, R., Fukai, S., Tanaka, T., Perederina, A., Vassylyev, D.G., Kohno, T., Maturana, A.D., et al. (2011). Structure and function of a membrane component SecDF that enhances protein export. Nature 474, 235–238.