创新数据非依赖性采集用于复杂基质目标蛋白质...(一)
创新数据非依赖性采集用于复杂基质目标蛋白质的定量分析
摘要 数据非依赖性采集(DIA)是随着定量蛋白质组学而建立的质谱扫描技术。DIA 能够获得扫描范围内所有母离子及二级子离子信息,不会造成低丰度离子信息的丢失,同时突破了高分辨质谱二级定量的通量限制。本研究基于静电场轨道阱Q-qIT-OT 三合一质谱,发展了经典DIA 方法以及WiSIM-DIA 和Full MS-DIA两种全新DIA 方法,并对Hela 细胞全蛋白中添加的10 条低浓度肽段进行定量分析,考察方法的线性、重现性和灵敏度。结果表明,3 种方法的定量限均低至amol (14 ~435 amol),并展示出良好的线性和定性确证可靠性。其中,WiSIM-DIA 基于超高分辨一级监测定量,与经典DIA 优势互补;Full MS-DIA 的选择窗口仅3 amu,能够直接进行搜库鉴定,实现了数据依赖性采集(DDA)和DIA 的统一,摆脱了DIA 依赖于DDA 建立谱图库的局限性。
关键词 静电场轨道阱; 数据非依赖性采集; 蛋白质组学; 绝对定量
1引言
数据依赖性采集(Data dependent acquisition, DDA)是串联质谱非目标化合物分析的主要手段。蛋白质组学的经典策略-鸟枪法(Shotgun)即基于DDA 发展而来,利用一级全扫描检测肽段母离子,然后按信号强度排列,将前若干位的母离子依次选择、碎裂,并扫描二级碎片离子。同时,动态排除、价态排除、中性丢失/ 诊断离子触发等技术,使DDA 尽可能多地采集有效肽段谱图,实现鉴定结果最大化[1] 。基于鸟枪法,蛋白质组学已经实现酵母蛋白质组接近完全覆盖,人类蛋白质组也已达到50% 以上的基因组覆盖和7 个数量级的动态范围[2,3] 。然而,DDA 的局限性也逐渐显现:(1) 先强后弱的采集方式易造成低丰度肽段信息丢失;(2) 母离子选择有一定的随机性,造成重现性不佳;(3) 每个循环获得的谱图数量不一,造成扫描点数不均匀,影响定量分析准确性。
目标蛋白质组学针对目标蛋白/ 肽段离子实时监测和采集,避免了DDA 的信息丢失和重现性问题。主要采集方法包括选择离子监测(Selected ion monitoring, SIM)、基于三重四极杆的选择反应监测(Selected reaction monitoring, SRM)和基于高分辨质谱的平行反应监测(Parallel reaction monitoring, PRM),是目标蛋白验证和绝对定量的有效手段[4,5] 。但是目标性的采集方法需要指定目标肽段,对于未知肽段无法采集;通量限制也使得一次实验只能监测数量有限肽段或离子对,难以满足大规模蛋白分析的需要。
数据非依赖性采集(Data independent acquisition, DIA)使用25 amu 或更大间隔将整个质量范围等分为若干窗口,每个窗口依次选择、碎裂、扫描。DIA 能够获得质量范围内所有母离子的全部碎片离子信息,通量无上限,循环时间固定,同时数据可以回溯,有效解决了DDA 和目标采集方法存在的问题[6] 。目前,已发展了多种基于飞行时间(Q-TOF)、静电场轨道阱(Orbitrap)和离子阱的DIA 方法[7] 。Gillet 等使用32 个连续的25 amu 窗口,基于Q-TOF (TripleTOF 5600)发展了SWATH 技术,并证明该技术的定量能力与SRM 相当[8] 。Egertson 等利用Q-Orbitrap (Q Exactive)独有的多重扫描功能(Multiplexing,MSX)发展了MSX-DIA 技术,将选择窗口缩小到4 amu,最大程度减少了共流出肽段和杂质的干扰[9] 。
然而,传统数据非依赖性采集仍存在诸多局限:(1) 由于扫描速度的限制,DIA 难以使用超高分辨率扫描;(2) DIA 的大窗口选择引入较大干扰,虽然MSX-DIA 缩小了选择窗口,但需要特定的算法解析数据,增加了工作量;(3) DIA 依赖于DDA 建立的谱图库进行匹配,实现定性确证和定量离子选择,因此DDA 鉴定不到的蛋白,DIA 也无法分析。
本研究基于四极杆-静电场轨道阱-线性离子阱(Q-OT-qIT)三合一质谱,利用添加10 条低浓度肽段的Hela 样本,发展并考察了3 种数据非依赖性采集方法,包括经典的DIA、全新的宽窗口SIM 扫描DIA(WiSIM-DIA)和全扫描DIA (Full MS-DIA),定量限均达到amol 水平,线性、重现性良好。其中,WiSIM-DIA 和Full MS-DIA 基于24 万超高分辨率,利用一级精确质量数定量、二级离子阱定性确证,进一步缩小了选择窗口,提高了检测特异性。此外,Full-MS DIA 可以直接搜库,实现了DDA 与DIA 的统一,蛋白鉴定数量与DDA 相当,摆脱了谱图库的限制。基于Q-OT-qIT 的数据非依赖性采集方法灵活多样、流程简单有效,在目标蛋白质组学领域具有广阔的应用前景。
2实验部分
2.1 仪器与试剂
Orbitrap Fusion 三合一质谱仪、EASY-nLC 1000 纳流超高效液相色谱(Thermo Fisher Scientific)。标准肽段由生工生物(上海)股份有限公司合成;乙腈、甲酸(Thermo Fisher Scientific);其它试剂均购自Sigma-Aldrich 公司。
2. 2Hela 细胞全蛋白酶解液制备
取适量Hela 细胞沉淀,加入含7 mol/ L 尿素、2 mol/ L 硫脲、1 mmol/ L 苯甲基磺酰氟(PMSF) 和50 mmol/ L 二硫苏糖醇(DTT)的蛋白提取液,在超声细胞破碎仪中超声3 次各5 s。冰上放置20 min后,4 益离心(15000 g) 30 min, 取上清液,Bradford 法确定总蛋白浓度。向蛋白提取液中加入DTT(终浓度10 mmol/ L),于56 益振荡30 min。加入碘乙酰胺(终浓度50 mmol/ L),室温避光振荡40 min。反应后加入6 倍体积的预冷丙酮,-20 益放置3 h,4 益离心(15000 g)30 min, 弃上清液。将蛋白沉淀溶于50 mmol/ L NH4HCO3 溶液,加入胰蛋白酶Trypsin(酶颐蛋白为1颐40, w / w),37 益酶解过夜。将全蛋白酶解液稀释至终浓度为100 mg/ L。
2.3 标准肽段添加
等重称取10 条标准肽段粉末,混合后使用0. 1%甲酸溶液充分溶解为1 g/ L 肽段混合溶液(总浓度10 g/ L)。肽段混合溶液进一步使用100 mg/ L Hela 酶解液逐级稀释为7 种浓度梯度(200, 50, 10, 2, 0.5,0.1 和0.02 mg/ L)溶液。另取少量标准肽段溶液用水稀释至500 mg/ L, 用作PRM 扫描,构建谱图库。
2.4 纳流液相色谱方法
色谱柱:自制纳流C18 色谱柱(3 滋m, 100 魡, 75 滋m 伊15 cm);上样量: 1 滋L;流速:300 nL/ min;A 相: 0. 1%甲酸溶液;B 相: 0. 1% 甲酸-乙腈溶液;分析梯度:0 ~4 min,3% ~10% B;4 ~74 min,10%~35% B;74 ~78 min,35% ~90% B;78 ~90 min,90% B。
2.5 质谱方法
离子源:nano-Flex 纳喷雾离子源;扫描模式:正离子;喷雾电压:2. 2 kV;离子传输管温度:275 益;RF-lens:60%。
DDA 扫描:一级扫描模式:全扫描;一级扫描范围:m / z 300 ~ 1800;一级检测:Orbitrap(分辨率240 K);选择模式:四极杆;选择窗口:2 amu;碎裂模式:CID;碎裂能量:30%;二级检测:离子阱;动态排除:60 s;循环时间:3 s。
PRM 扫描:母离子列表:10 条标准肽段的精确质量数;选择模式:四极杆;选择窗口:2 amu;碎裂模式:HCD;碎裂能量:30%;二级检测:Orbitrap(分辨率30 K);循环模式:按母离子列表依次扫描。
DIA 方法:母离子列表:m / z 510 ~890, 间隔20 amu;选择模式:四极杆;选择窗口:20 amu;碎裂模式:HCD;碎裂能量:30%;二级检测:Orbitrap(分辨率30 K);二级扫描范围:m / z 150 ~2000;循环模式:按母离子列表依次扫描。
WiSIM-DIA 方法:一级扫描模式:SIM;一级选择模式:离子阱;一级扫描范围:m / z 400 ~ 600, m / z600 ~800, m / z 800 ~1000;一级检测:Orbitrap(分辨率240 K);母离子列表:m / z 406 ~598, m / z 606 ~798, m / z 806 ~998 间隔12 amu;二级选择模式:四极杆;选择窗口:12 amu;碎裂模式:CID;碎裂能量: 30%;二级检测:离子阱;二级扫描范围:m / z 150 ~2000;循环模式:3 个SIM+3 个母离子列表依次扫描。Full MS-DIA 方法:一级扫描模式:全扫描;一级扫描范围: m / z 400 ~1000;一级检测:Orbitrap(分辨率240 K);母离子列表:m / z 401. 5 ~518. 5, m / z 521. 5 ~638.5, m / z 641. 5 ~758. 5, m / z 761. 5 ~878. 5,m / z 881.5 ~998.5, 间隔3 amu;选择模式:四极杆;选择窗口:3 amu;碎裂模式:CID;碎裂能量:30%;二级检测:离子阱;二级扫描范围:m / z 150 ~2000;循环模式:5 个一级全扫描+5 个母离子列表依次扫描。
2.6 数据处理
标准肽段PRM 数据使用Proteome Discoverer 1. 4 软件进行搜库鉴定,母离子质量精度:10 ppm,子离子质量精度:0. 02 Da。鉴定结果作为谱图库进行DIA 的定性确证和定量离子挑选。DIA 数据使用Pinpoint 1. 4 软件进行谱图库离子筛选、定性确证、定量分析和标准曲线绘制。质量精度设置同上,母离子定量选择单同位素峰和第一个同位素峰,子离子定量选择强度最高的2 个y 离子,定性确证选择强度最高的8 个子离子。100 ng Hela 细胞全蛋白DDA 和Full MS-DIA 数据使用Proteome Discoverer 1. 4 软件进行Uniprot 人类蛋白数据库搜库鉴定与比较,质量精度设置同上(Full MS-DIA 母离子质量精度设置为1. 5 Da),可变修饰:甲硫氨酸氧化(M+15. 995 Da),固定修饰:半胱氨酸脲甲基化(C+57. 021 Da)。鉴定结果使用Percolator 进行严格卡值(q<0. 01)。
3结果与讨论
3.1 基于Q-qIT-OT 的创新数据非依赖性采集策略的建立
数据非依赖性采集依次扫描整个质量范围的所有母离子及二级子离子,循环时间长,因此对质谱扫描速度要求高。目前,主要的DIA 方法的质谱扫描速度均在10 Hz 左右,例如SWATH 等,因此采用较大选择窗口(25 ~50 amu),以缩短循环时间(约2. 5 ~3. 2 s)。Q-qIT-OT 三合一质谱集四极杆、线性离子阱和Orbitrap 3 种质量分析器为一体,Orbitrap 扫描速度达到15 Hz,线性离子阱达到20 Hz,为缩短传统DIA 的选择窗口、降低干扰、提高灵敏度提供了可能[10] 。
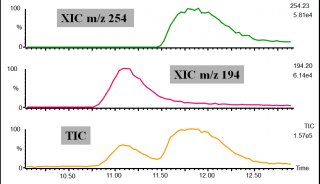
本研究首先基于四极杆和Orbitrap,建立了经典DIA 方法(图1A):使用20 amu 选择窗口,利用Orbitrap 30K 高分辨率和HCD 高能碎裂,依次选择、碎裂、扫描整个质量范围(m / z 500-900),循环时间仅为1. 9 s,数据处理时挑选强度最高的子离子组成母子离子对进行色谱峰提取和定量。此外,利用线性离子阱的高灵敏度和高扫描速度,建立了两种基于一级定量的新方法:宽窗口SIM 扫描DIA (WiSIM-DIA)和全扫描DIA (Full MS-DIA)。
WiSIM-DIA(图1B)利用200 amu 宽窗口筛选母离子,在m / z 400 ~1000 范围依次使用Orbitrap 进行240 K 超高分辨离子监测扫描,最大程度排除基质干扰,基于一级精确质量数进行定量。在每个SIM扫描之后,利用12 amu 窄窗口选择母离子,在质量范围内依次进行线性离子阱二级碎片离子扫描,基于二级谱图实现定性确证。
Full MS-DIA(图1C)在WiSIM-DIA 基础上将12 amu 选择窗口缩短到3 amu,达到与DDA 相当的选择窗口,但扫描窗口数量增加了4 倍。为了避免循环时间过长对定量造成的影响,在m / z 400 ~1000 的质量范围内插入5 个Orbitrap 240 K 超高分辨一级全扫描以保证扫描点数。Full MS-DIA 一级扫描间隔仅2. 6 s,保证了定量结果的可靠性。