中途胚胎植入前遗传学诊断/筛查病例报告-2
三、讨论
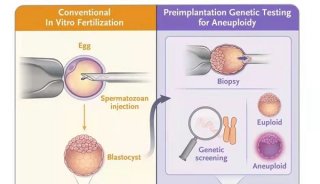
计划PGD/PGS在胚胎实验室的流程为:取卵→ ICSI受精→D3胚胎期打孔→D5囊胚活检→囊胚 冷冻 → 对回报可用囊胚择期行解冻移植。而在 Midway PGD/PGS,实验室流程被动变为取卵→ IVF受精→囊胚冷冻→囊胚解冻复苏→囊胚打孔、 活检→再次囊胚冷冻→对回报可用囊胚择期再次行 解冻移植。那么以下问题就需要探讨:( 1)PGD/ PGS能否采取IVF受精?( 2)囊胚期打孔是否可 行?( 3)反复冻融对胚胎发育有无影响?为此我们 复习了多项PGD/PGS指南,包括2004年PGD国 际协会颁布的 PGD 技术指南及于2008年修正的 PGD操作流程及实验室质量保障指南[ 2]、欧洲人类 生殖与胚胎协会( ESHRE)PGD联盟就 PGD实验 室的设立及相关的3项技术———DNA扩增技术、荧 光原位杂交( FISH)技术和胚胎活检———建立的相 关指南[ 3 -5]、 2015 年 Tur -Kaspa 等[ 6]提出的用于 HLA配型的 PGD 指南及 Girardet等[ 7]2016年提 出的囊性纤维瘤PGD指南、加拿大妇产科医生协会 2015年发布的胚胎植入前基因诊断和筛查技术指 南[ 8],以及其他相关文献,以期回答上述问题。 1.PGS/PGD 受精采用ICSI还是IVF:选择 ICSI的理由包括:( 1)增加2PN率,提高卵子利用效 率;( 2)避免精子来源的污染。因此目前所有指南对 包含PCR步骤的PGS/PGD均推荐使用ICSI,目的 即是减少来自黏附于囊胚透明带的父系精子 DNA 污染;荧光原位杂交( FISH)则IVF和ICSI受精两 者均可[ 5, 9]。进一步细分,所有PGD中授精步骤均 推荐使用ICSI而非常规授精[ 4, 10];而对于 PGS,目 前美国 CooperGenomics公司采用IVF受精,并将 此写入其认证的操作流程。他们的依据在于,对多 达50条的精子进行扩增后并无 DNA产物,因此无 需担心粘附于透明带上的精子污染。但对PGD病 例仍要求采用ICSI授精,尤其是采用短串联重复序 列多态性连锁分析( STR-PCR)扩增进行单基因 PGD时,因为细胞裂解过程可放大精子物质。由于 所用扩增方法不同,导致精子 DNA 扩增程度也不 同,因此采用何种受精方式建议参考各实验室流程、 单细胞扩增技术和验证流程。此外,还需要关注另 一种污染,即卵丘细胞污染。有一例胚胎PGD诊断 结果为46,XX,但新生儿出生为46,XY,其 DNA指 纹显示为母体来源。推测原因可能是把一团粘附的 滤泡细胞误认为是脱出的滋养层细胞进行了“活检”。
不管采用哪种受精方法都有发生这种污染的可能,因 此操作人员在活检过程中仔细识别活检材料非常 重要。 2.解冻囊胚打孔( z ona breaching):针对囊胚 期活检,指南中推荐在胚胎期打孔、在囊胚期对从孔 中突出的滋养外胚层细胞进行活检[ 1]。但也有缺 点:若后期形成的内细胞团位于打孔处,则活检操作 可能损伤已分化的内细胞,影 响 后 续 胚 胎 发 育[ 11 -13];效率低———打孔的胚胎不一定都能发育成 囊胚。也有文献尝试在囊胚期打孔[ 14]。相较卵裂 期打孔,囊胚期打孔优点在于:( 1)打孔位置可选择, 可避开内细胞团附着处;( 2)避免对囊胚发育过程的 干扰。但该方法需要先对囊胚进行皱缩、等到囊胚 再次复张并孵出才能活检,部分情况下当天是无法 完成活检。本研究中为解冻囊胚,操作时可以选择 合适时机,即在囊胚解冻后尚有一定程度皱缩状态 下、选取远离内细胞团处、透明带薄、且和滋养外胚 层有一定间隙处打孔,然后放置培养箱孵育,待有滋 养外胚层细胞从打孔处突出时取活检,则可以最大 限度避免对滋养外胚层细胞的损伤。 3.反复冻融对胚胎发育的影响:冷冻技术是 PGD/PGS过程中一项重要步骤,为囊胚活检后的 遗传检测赢得了时间。目前采用的玻璃化冷冻技术 经20多年的发展,目前已广泛用于人类卵母细胞、 原核期胚胎、卵裂期胚胎和囊胚的冷冻,获得了较高 的解冻复苏率,很多文献报道冻融胚胎和冻融囊胚 移植是可行和安全的[ 15 -17]。但目前尚缺乏对玻璃 化胚胎出生婴儿终生随访的全面资料,胚胎反复冻 融其临床有效性、安全性更需人们关注。临床工作 中胚胎反复冻融大都为特殊情况下的非常态操作, 相关的研究较少。2015年的一项研究显示,重复冷 冻组的胚胎种植率、临床妊娠率比单次冷冻组 低[ 18];最新的一篇文献也显示反复冻融组自然流产 率高于对照组而活产率低于对照组[ 19]。二次冻融 影响妊娠结局可能与多个因素相关。首先,多次玻 璃化冷冻过程中使用较高浓度的冷冻保护剂可使细 胞发生毒性效应和渗透性休克。现普遍认为,乙二 醇是人胚胎、受精卵、卵母细胞玻璃化冷冻最有效的 低毒性冷冻保护剂,冻融后存活率高,但其与胚胎接 触时间过长(>2min)、温度过高(>25℃)时,其细 胞毒性作用增强。其次,尽管认为玻璃化冷冻中极 少有胞内冰晶形成,但当预平衡或暴露于玻璃化溶 液中时间过短时,会发生细胞脱水和冷冻保护剂置换不充分,此时会产生胞内冰晶,对细胞造成损伤。 反复冷冻情况下这些不良事件发生概率增加、不利 影响累加,最终可能影响到胚胎发育潜能。这就要 求胚胎学家操作严格按照流程进行,同时也要求我 们工作中尽可能个体化处理、准确预判,任何情况下 都要尽可能避免对胚胎反复冻融。 总之,中途行 PGD/PGS与计划行 PGD/PGS 在操作程序有诸多不同,现有指南未涉及,目前无指 导性建议。其中IVF 受精、反复冻融有可能影响 PGD准确率和胚胎进一步发育潜能,如何评价其效 果有待进一步积累经验。
参考文献略。
-
焦点事件

-
科技前沿