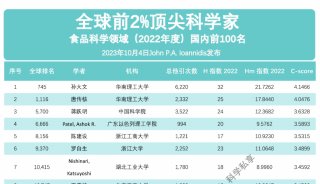
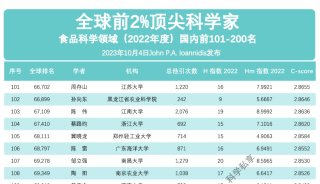
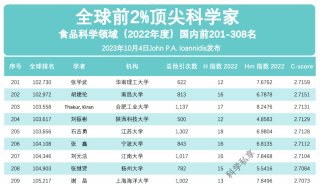
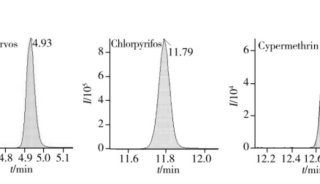
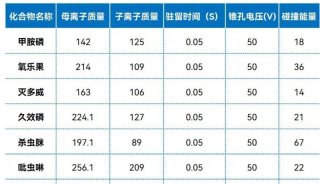
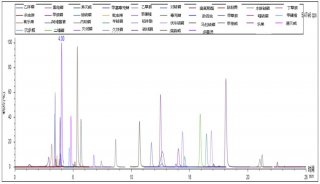
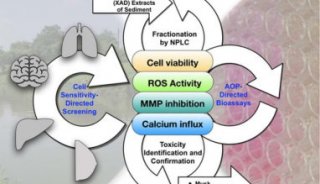
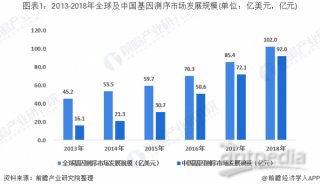
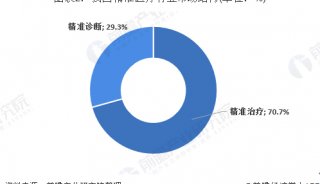
高通量基因测序植入前胚胎遗传学诊断和筛查技术规范-2
三、实施高通量测序PGD/PGS前的临床咨询和知情同意书的签署
本项技术的实施应坚持知情选择、自愿的原则,接受本项技术的患者应签署知情同意书。
1.应用高通量测序技术进行基因疾病PGD是确认诊断,而PGS是排除性诊断。医师应该事先告知患者及其家属PGD/PGS的性质、目的、意义和方法及其局限性,以及确认诊断和排除诊断的差异及其可能的风险。应告知患者及其家属现存可行的替代方法及各自的优势和局限;
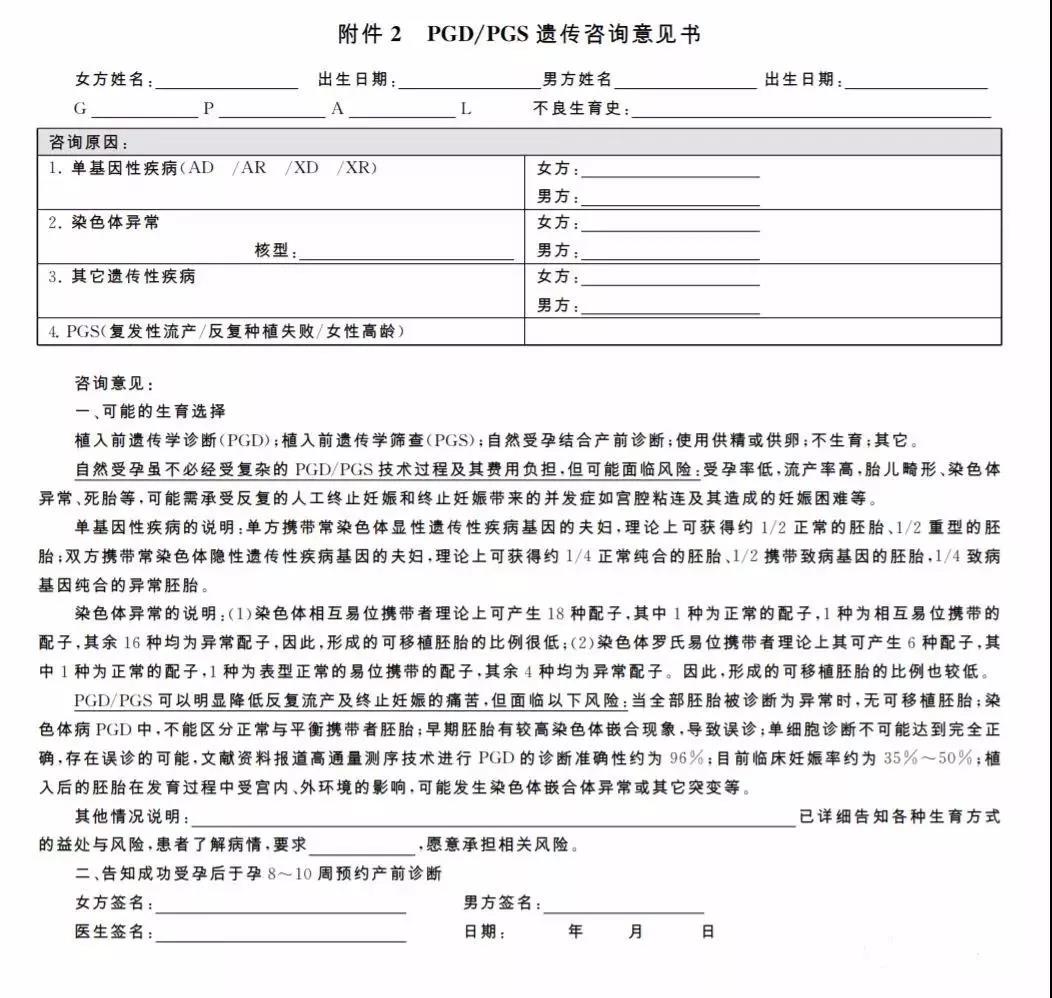
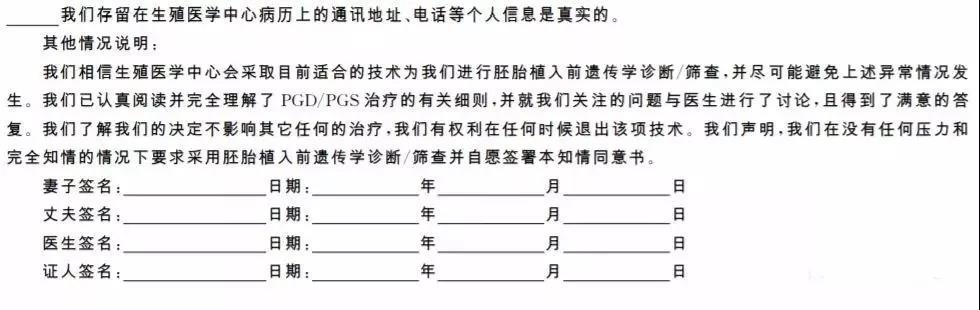
2.签署知情同意书之前,医疗机构应该有专门负责的医师对患者进行遗传咨询并解释知情同意书的要点。遗传咨询意见书可参考附件2,知情同意书可参考附件3制定。

(1)机构应告知患者本项技术通常能够达到的检出率、误诊率及其可能的原因等,应强调经本项技术后的妊娠须适时进行介入性产前诊断以进一步确诊,避免误诊的危害;
(2)告知患者本项检测有失败的风险,必要时需重新进行活检;
(3)应告知本项检测的局限性,如在染色体相互易位的携带者中可能无法区分正常和平衡携带的胚胎,目前尚难以进行5Mb以下的拷贝数变异的诊断等;
(4)解释医师对病例个案认为应该说明的问题以及患者提出的其它疑问。
四、临床资料的收集和胚胎遗传物质的活检
1.临床资料的收集:临床医师应详细询问患者的遗传病的家族史、先证者的情况、致病基因的检测方法和结果以及孕产史等情况。其必要的原始资料或其复印件应保存在医疗档案中。
2.胚胎活检:
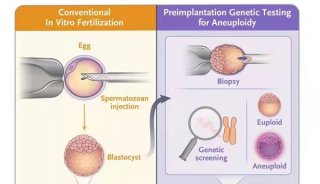
(1)依据技术体系的差异,在PGD/PGS中可进行极体、卵裂球或囊胚滋养外胚层细胞等遗传物质的采样。根据现阶段的循证医学资料,建议采用囊胚滋养外胚层细胞的活检;
(2)采用唯一编号对活检的胚胎生物样本进行编号;
(3)活检样本的处理按全基因组扩增试剂盒说明书进行;
(4)填写高通量测序检测申请单。申请单可参考附件4。

3.胚胎活检生物样本的储存和运输
(1)已进行全基因组扩增的样本运输:样本在4~8℃冷藏条件下冷链运输,运输时间建议在4h内;在0℃以下的冷冻运输不超过72h;
(2)已进行全基因组扩增的样本的长期保存应在-80℃,保存过程中尽量避免反复冻融。
五、高通量测序检测及其结果的审核和发放
1.本项检测应在接收到待检物的30个工作日内完成并出具检测报告,其中发出因检测失败需再次采样的通知应不长于15个工作日;
2.检测报告需由医疗机构具副高级及以上职称、熟悉并从事本项技术的医务人员审核后以书面形式发放至患者,医务人员应事先告知患者获取该报告的时间和地点。检测报告可参考附件5;

3.报告应包括以下信息:
(1)患者的姓名、年龄、采用本项技术的适应证;
(2)胚胎的编号、胚胎的状态、采样日期和报告日期;
(3)检测的项目和检测方法以及测试的检测级别分类(A、B、C);
(4)检测报告应对每个被检胚胎的检测结果以标准的专业方式描述。常染色体隐性遗传性基因疾病的PGD应明确是正常、致病基因杂合子或纯合子,或致病基因复合杂合子(重型)胚胎;常染色体显性遗传性疾病的PGD应明确是正常或重型胚胎,染色体病的PGD以是否出现易位和非易位染色体数目和/或结构的改变来表示,PGS以是否出现染色体非整倍体的改变来表示。必要时根据检测结果辅以其它的描述或说明;
(5)检测报告还应包括每个胚胎的测序深度,致病基因的直接测序结果及其上、下游可用于单体型分析的SNP位点数;
(6)检测中发现的拷贝数变异,应根据目前的资料对其进行分类,包括致病性的(5类)、可能致病性的(4类),以及从临床意义不明到可能良性和良性的(1~3类);
(7)检测者、审核者;
(8)其它相关提示。
六、检测后的临床咨询
医疗机构应直接向患者夫妇解释各胚胎的检测结果,根据检测结果明确胚胎的处置方式并根据具体情况为患者提供专业建议;对于结果为可移植的低风险胚胎,应提示不排除误诊的可能。
七、移植后妊娠结局的追踪随访
1.对PGD/PGS受术者及其子代的随访率必须达100%;
2.随访内容包括:胚胎移植后妊娠的情况、产前诊断的结果、产科情况、妊娠结局、胎儿或新生儿的表型等情况以及遗传学诊断和其它的临床诊断;
3.各阶段应根据具体情况为患者提供进一步处理的建议。
八、资料与标本的保存
实施本项技术全过程相关的原始资料,包括患者的病案、知情同意书、高通量测序检测申请单、原始实验数据记录、相关的电子信息文档、高通量测序检测报告单等,均应在医疗机构保存30年以上,相关的电子信息文档及剩余胚胎生物扩增样本应保存至产后2年以上。必要时重新进行本项检测以进一步核实检测结果。
肆
本项技术的临床及实验室质量控制
一、为了切实保障患者及其子代的利益,提高人口素质,参与本项技术的各机构须严禁本项技术商业化,严禁本项技术被滥用于进行无医学指征的胚胎性别选择。
二、活检的胚胎及其扩增的生物标本采用唯一编号并与申请单及报告单保持一致,标示清晰无破损或污染。
三、应由临床和实验室专家制定“核心疾病基因列表”。
四、必须建立所检测的胚胎的全基因组低覆盖度测序技术分析拷贝数变异(CNV)的标准化检测流程。
五、必须建立检测的胚胎单核苷酸多态性(SNP)或基于短串联重复序列(STR)的胚胎单体型的数据库,并具备高通量基因测序技术结合单体型分析的标准化检测流程。
六、PGS测序产出的数据中能够唯一比对上参考序列的条数>40万条。
七、基因性疾病的PGD测序平均深度至少需达到100×;应该进行靶基因上下游紧密连锁的SNP位点或STR分析,以通过相互印证、多途径确保最终诊断结果的准确性,降低误诊的发生率。
八、所有关键步骤的操作至少由2人完成,一人操作,一人核对并记录。
九、必须采取保障措施对所有相关数据进行长期存储。
十、基因性疾病和染色体病胚胎诊断的检出率不低于96%。
-
企业风采

-
焦点事件

-
焦点事件

-
政策法规
-
科技前沿

-
科技前沿

-
科技前沿

-
项目成果

-
产品技术

-
产品技术
-
企业风采

-
焦点事件

-
焦点事件

-
焦点事件

-
市场商机

-
企业风采

-
焦点事件

-
科技前沿
-
焦点事件

-
科技前沿
-
项目成果
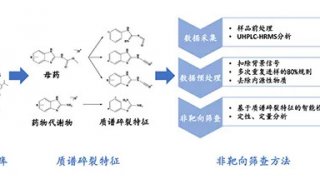
-
科技前沿

-
焦点事件

-
项目成果
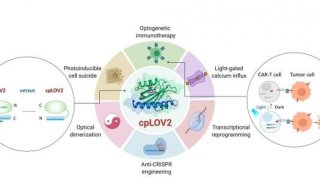
-
焦点事件

-
焦点事件

-
项目成果
-
项目成果
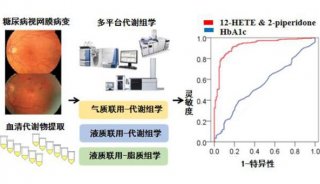
-
产品技术

-
焦点事件

-
焦点事件

-
焦点事件

-
焦点事件
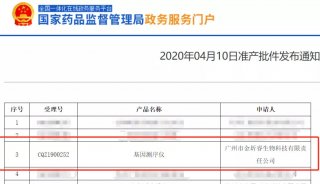
-
技术原理
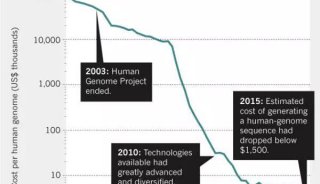
-
技术原理

-
焦点事件
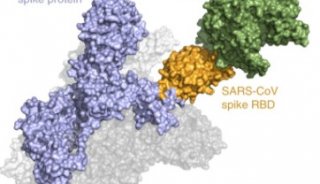
-
焦点事件

-
综述

-
科技前沿

-
招标采购

-
科技前沿
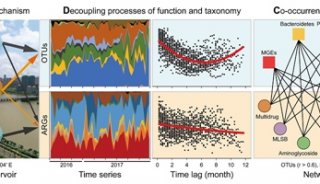
-
项目成果
-
科技前沿