一例乳腺HL病例分析
一、病例资料
患者,男性,71岁。因发现右乳、右腋下、左锁骨上肿块1个月余,于2015年11月6日入我院。1个多月前患者发现右乳1枚直径约2 cm肿块,迅速增大至鸡蛋大小,伴周围皮肤发红,局部无破溃,无乳头溢液,无橘皮征,同时于右腋下及锁骨上分别发现1枚直径约3 cm肿块;患者伴盗汗、全身皮肤瘙痒,无发热,无体质量下降。查体:右乳外上象限触及1枚约5 cm×3 cm肿块,质硬,形态不规则,边界不清,活动度不佳,无压痛,皮温高;左乳未触及肿块;右腋下及左锁骨上分别可触及1枚约3 cm×3 cm类圆形淋巴结,质偏硬,边界清,活动度一般,有压痛;余浅表淋巴结未触及肿大。左额部见直径约2.5 cm肿块,表面破溃。心、肺、腹检查无异常。神经系统查体无异常。入院后患者分别在B型超声定位下行右乳肿块细针穿刺活组织检查术及左锁骨上淋巴结活组织检查术。术后病理示:组织见少量异形大细胞(图1A),慢性炎症细胞及嗜酸细胞,左锁骨上淋巴结组织中可见RS细胞(图1B),考虑淋巴瘤。进一步行免疫组织化学检查,结果示:CD30+(图1C),CD15-(图1D),CD20+,CD3-,Ki-67+(60 %),CD10-,CK-,EMA-,CD45RO-,CD79a-。病理诊断:经典型HL(混合细胞型)。相关检查:血常规、肝及肾功能、血糖、凝血功能正常。乳酸脱氢酶(LDH)276 U/L。EB病毒核酸检测阳性。人类免疫缺陷病毒(HIV)阴性。心电图正常。颈、胸、腹增强CT示:颈部、两侧锁骨上下区、腋窝及腹股沟区多发淋巴结肿大,右乳外侧多发类圆形软组织密度影,边界不清,大小5.2 cm×2.5 cm(图2)。头颅磁共振成像(MRI)示左额部局部软组织结节状增厚,转移待排除。骨髓常规、免疫分型、染色体正常。诊断:HL ⅢE期B组(混合细胞型)。国际预后指数(IPI)评分为3分,属于中高危组。予患者1.5个周期的ABVD方案(长春地辛+博莱霉素+达卡巴嗪+表柔比星)化疗,复查乳腺B型超声示右侧乳腺组织可见低回声团多枚,较大者3.3 cm×1.7 cm,LDH 246 U/L。后患者要求转外院治疗。电话随访,在外院继续化疗(具体方案不详),病灶曾进一步缩小,但患者病情进展迅速,于2016年7月7日死亡。
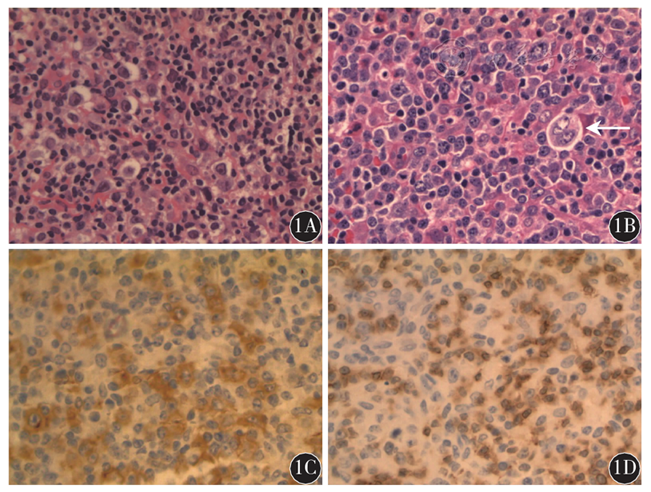
图1男性乳腺霍奇金淋巴瘤患者病理检测结果×40
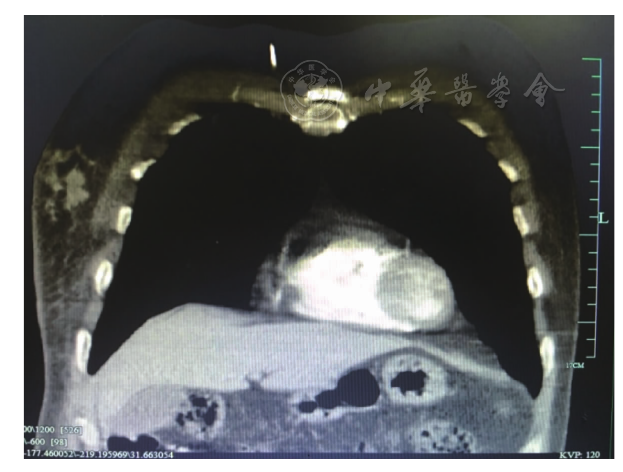
图2 男性乳腺霍奇金淋巴瘤患者右侧乳腺区胸部CT检查结果
二、讨论
HL较为少见,不足全部恶性肿瘤的1 %,在我国发病率略低。HL通常原发于淋巴结,仅15 %~30 %发生于结外组织,以侵犯胸腔内组织最常见,累及乳腺者极少见。从1928年Kuckens报道第一例乳腺HL以来,至今国内外尚缺乏乳腺HL的大型临床研究,仅有极少数个案报道。
乳腺淋巴瘤分为两类:原发性乳腺淋巴瘤(PBL)和继发性乳腺淋巴瘤。PBL的诊断标准是1972年由Wiseman和Liao首次提出并被广泛使用的,包括:病灶位于乳腺,伴或不伴同侧腋窝淋巴结累及,不存在乳腺外淋巴瘤病变及全身广泛播散,既往无淋巴瘤病史。但由于该标准限制多,也有学者倾向于放宽PBL的诊断标准,以乳腺为首发或主要的发病器官,即使发现有远处淋巴结或累及骨髓者也包含在内。继发性乳腺淋巴瘤则是全身淋巴瘤的一部分。本例患者发病时同时出现乳腺肿块、全身多部位淋巴结肿大,尽管乳腺病变最明显,我们仍难以区分其为原发或继发。回顾文献,多数学者认为继发乳腺HL比原发乳腺HL更常见。也有少部分学者认为原发乳腺HL和继发乳腺HL几乎各占一半。
乳腺HL发病率极低。Wood和Coltman在一项354例HL淋巴结外病变的回顾研究中发现,仅8例(0.02 %)患者侵犯乳腺。而NHL比HL更容易侵犯乳腺,1%的NHL在发病过程中侵犯乳腺。邱立华等研究表明,1960年至2007年我国天津市的乳腺淋巴瘤的发病率为59/103万,49例乳腺淋巴瘤患者中HL仅1例。乳腺HL的发病机制目前不详,可能与EB病毒感染相关,具体可能是被EB病毒感染的B细胞出现信号通路和转录因子活性失调,从而引发HL。本例患者找到血清EB病毒感染的证据,遗憾的是未进一步检测乳腺淋巴瘤细胞中是否存在单克隆EB病毒基因组,故EB病毒感染与HL发病是否存在关联仍有待进一步研究。另外,性激素可能在发病过程中起了重要作用,有研究表明HL细胞中存在雌激素受体β的表达。
乳腺HL发病年龄为16~50岁,几乎均为女性,男性偶有报道,我们仅检索到2例相关报道。乳腺HL临床症状不典型,多以单侧乳腺无痛性、活动性肿块为首发或主要症状,右乳为常见发病部位,亦有报道左乳或双乳发病。乳头内陷或橘皮样改变、乳头溢液症状少见。其他症状主要为同侧腋窝淋巴结肿大、颈部淋巴结肿大、皮肤瘙痒等,部分患者存在B症状,如发热、盗汗和体质量下降。乳腺HL影像学无特殊性,难以与乳腺NHL和乳腺癌区分。本例患者乳腺B型超声提示多枚融合低回声团块,边界不清,皮下组织明显增厚。CT提示乳腺肿块边界不清,增强扫描后明显持续强化,与既往报道类似。本例乳腺HL患者为71岁男性,以右侧乳腺无痛性肿块急剧增大为主要表现。因此,临床上对有无痛性乳腺肿块,尤其是短期内肿块迅速增大、伴或不伴淋巴结肿大的患者,应考虑淋巴瘤的可能。
由于乳腺HL有独特的病理学表现,因此确诊依据组织病理学及免疫组织化学检查结果。HL共同的组织学特征是在多种炎性细胞背景中见到形态不一、数量不等的肿瘤细胞,即诊断性及变异型RS细胞。几乎所有肿瘤细胞CD30+,75 %~85 %的病例CD15+,40 %的病例CD20+。细针穿刺细胞学(FNAC)检查因存在取材少、缺乏组织结构等缺点,在诊断HL及确定组织亚型上存在困难。因此,临床上不推荐给予FNAC检查,应尽可能予以活组织检查。本例患者因细针抽取的组织少,进一步行锁骨上淋巴结活组织检查协助明确诊断。乳腺NHL占乳腺淋巴瘤的70 %~90 %,以弥漫大B细胞淋巴瘤最常见(56 %~84 %);乳腺HL临床少见,其病理学分布尚鲜见明确报道。然而,Bano等进行的一项巴基斯坦单中心20年乳腺淋巴瘤回顾性研究显示,3例乳腺HL的病理类型均为经典型HL中的结节硬化型。Osuji等、Modi等、Hoimes等报道的病例亦为结节硬化型HL。本例患者则是经典型HL中的混合细胞型。
当乳腺HL确诊后,必须完善全身影像学检查及骨髓检查,以明确分期。全身影像学检查目前主要是头颅MRI、胸腹部及盆腔增强CT等,如经济条件允许建议行全身PET-CT检查。18F-FDG PET-CT显像是目前公认的灵敏度及特异度最高的影像学检查方法,被推荐用于HL的常规分期和疗效评价,但不推荐用于常规随访。此外,Adams等对10个PET-CT中心的1389例HL进行Meta分析,结果显示中期PET-CT对HL有提示预后和指导后续治疗的价值。
因研究的乳腺HL病例有限,目前治疗尚无统一的标准方案。手术治疗目前还存在争议,但多数学者认为大范围的手术不仅不能改善患者的总生存(OS)及复发率,更可能因创伤导致放化疗延迟而对预后不利,不建议行大范围的乳腺根治术或肿块切除术。一项多中心研究报道,放疗能改善乳腺淋巴瘤局部肿块的控制,而非改善无病生存(PFS)及OS。化疗联合放疗可能是治疗乳腺HL最有效的手段[12]。Hoimes等报告1例45岁女性乳腺HLⅣ期患者,予8个周期ABVD方案治疗后随访2年,疾病完全缓解(CR)。Osuji等报道的乳腺HL患者予ABVD方案化疗后CR,预后良好。然而,本例患者在我院初始予以1.5个周期ABVD方案治疗后乳腺肿块虽然较前缩小,但远远未达到CR状态,甚至转院治疗后病情仍进展,生存期仅7个月。原因可能是本例患者为晚期、难治HL,也可能与患者EB病毒DNA阳性有关。ABVD方案被认为是大多数HL的一线治疗方案,但仍有10 %左右的患者不能达到CR,且近1/3的患者治疗后复发。近年来HL的治疗也取得了突破性进展。研究表明,通过阻断程序性死亡受体1(PD-1)的肿瘤免疫治疗方法可以有效治疗HL,此项研究成果被选为第56届美国血液学会(ASH)年会的最佳报告[28]。另外,靶向药物如抗CD30单抗偶联毒性药物BV在欧美已被批准上市,mTOR抑制剂sirolimus等正在积极临床试验中。新药是否能提高乳腺HL患者的疗效及改善预后,有待进一步研究。
本例患者预后差,可能存在的预后不良因素是老年、男性、B症状、肿块直径4~5 cm、Ann arbor分期大于ⅠE期、较差的体能状态,与相关文献相符。
总之,乳腺HL发病率低,无特殊临床表现,依赖组织病理学及免疫组织化学检查确诊,其病理分型以结节硬化型常见。乳腺HL预后欠佳,应综合判断,选择个体化治疗方案,乳腺根治术等大范围手术对治疗及预后无益,化疗联合放疗可能是目前有效的治疗方式。







